
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Потенциометрические методы анализа
|
|
|
|
Высокочастотное кондуктометрическое титрование
Метод основан на измерении электропроводности при частотах несколько МГц. Существенное отличие высокочастотного титрования от низкочастотного заключается в том, что электроды можно расположить на наружных стенках сосуда – кондуктометрической ячейки. Это отличие важно при работе с агрессивными средами (царская водка, олеум). Этот метод точен и дает возможность измерить электропроводность любых сред.
Основаны на зависимости потенциала индикаторного электрода от концентрации потенциалопределяющих ионов.
Применяют различные электродные системы и различные электроды.
Электроды I рода представляют собой металлическую пластину, погруженную в раствор соли, содержащей катионы этого металла. Формула Нернста связывает потенциал индикаторного электрода с концентрацией потенциалопределяющих ионов:
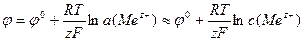 ,
, 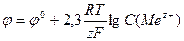 ;
;  , где φ0 – стандартный электродный потенциал, измеренный по отношению к водородному электроду при стандартных условиях; R – универсальная газовая постоянная; Т – абсолютная температура; F – число Фарадея (96485 Кл/моль); z – число электронов, участвующих в элементарном акте электрохимической реакции.
, где φ0 – стандартный электродный потенциал, измеренный по отношению к водородному электроду при стандартных условиях; R – универсальная газовая постоянная; Т – абсолютная температура; F – число Фарадея (96485 Кл/моль); z – число электронов, участвующих в элементарном акте электрохимической реакции.
Электроды II рода представляют собой металл, покрытый трудно растворимой своей солью и погруженный в раствор соли, содержащей одноименные анионы соли. К электродам второго рода относят хлоридсеребряный электрод, представляющий собой серебряную пластину или проволоку, покрытую слоем AgCl и погруженную в раствор КCl. Этот раствор сообщается с исследуемым раствором через солевой мостик или другое приспособление, затрудняющее смешение растворов. Через асбестовое волокно, во-первых, осуществляется электролитический контакт с исследуемым раствором, а во-вторых, благодаря большому гидродинамическому сопротивлению асбеста не происходит смешивания раствора КCl с исследуемым раствором. Формула Нернста имеет вид  .
.
|
|
|
В случае окислительно-восстановительных систем, когда восстановленная и окисленная формы находятся в растворе, электродный потенциал благородного металла (платина), погруженного в раствор этих ионов, будет равен:  , где ox – окисленная форма, red – восстановленная форма.
, где ox – окисленная форма, red – восстановленная форма.
Потенциометрические ячейки представляют собой электродную систему из электрода сравнения, потенциал которого не зависит от природы раствора, и индикаторного электрода, потенциал которого чувствителен к природе каких-либо ионов или растворенных веществ.
В качестве электродов сравнения в настоящее время используют 2 типа электродов II рода: хлоридсеребряный (см. выше) и каломельный электрод. Каломельный электрод представляет собой слой ртути, покрытый слоем каломели Hg2Cl2, над которым находится раствор КCl. Контакт с внешней средой осуществляется платиновой проволокой. Раствор КCl контактирует с исследуемым через асбестовое волокно. В качестве индикаторных электродов применяют при определении окислительно-восстановительных систем – платиновые, золотые электроды, электроды из углеродных материалов (стеклоуглерод). При измерении рН и некоторых щелочных металлов (натрий, кальций …) используют мембранные электроды.
pХ = -lg c(Х+); где Х – природа вещества. Например, pН = -lg c(H+).
Схема стеклянного электрода, используемого для измерения кислотности среды.
Стеклянный электрод – трубка из электропроводного стекла, заканчивающаяся внизу шариком с очень тонкой стенкой – мембраной. Наружная часть мембраны контактирует с исследуемым раствором. Электрод заполнен буферным раствором (0,1 н раствор НСl с рН = 1,1). Контакт с НСl осуществляют с помощью хлоридсеребряного электрода. Потенциал стеклянного электрода: 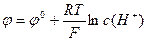 или
или 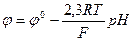 . Потенциал на мембране реализуется в результате равновесного процесса: перехода ионов Li+ в раствор, а ионов Гидрогена Н+ в стекло. Li+стекло + H+раствор↔ Li+раствор+ H+стекло.
. Потенциал на мембране реализуется в результате равновесного процесса: перехода ионов Li+ в раствор, а ионов Гидрогена Н+ в стекло. Li+стекло + H+раствор↔ Li+раствор+ H+стекло.
|
|
|
Аналогично ведут себя электроды из стекла, чувствительные к ионам Na+, Ca2+, Li+ и др. Формула Нернста: 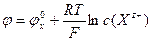 или
или  , х – ион, к которому чувствительна мембрана. Известно много ион-селективных электродов, чувствительных к разным катионам и анионам. Недостатком этих электродных систем является одновременная чувствительность к другим ионам.
, х – ион, к которому чувствительна мембрана. Известно много ион-селективных электродов, чувствительных к разным катионам и анионам. Недостатком этих электродных систем является одновременная чувствительность к другим ионам.
|
|
|
|
|
Дата добавления: 2017-01-13; Просмотров: 447; Нарушение авторских прав?; Мы поможем в написании вашей работы!