
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кулонометрический анализ
|
|
|
|
Подготовка рН-метра или иономера для проведения измерения
1. Прогревают 15 минут.
2. Калибруют по стандартным буферным растворам. Помещают электродную систему в стандартный буферный раствор с рН = 1,1. Выставляют это значение на приборе. Электроды промывают дистиллированной водой. Помещают электродную систему в стандартный буферный раствор с рН = 9,18. Выставляют это значение на приборе. Электроды промывают дистиллированной водой. Эту процедуру повторяют несколько раз, пока на приборе самопроизвольно не будет нужного значения рН.
3. Собственное измерение.
Кулонометрическое титрование базируется на электрохимической организации титранта непосредственно в растворе с веществом, которое титруют. Такая генерация титранта позволяет упразднить операции дозировки титранта в титруемый раствор из бюретки. Сущность метода заключается в том, что параллельно с электрохимической реакцией, протекающей под действием электрического тока, в растворе происходит также химическая реакция между определяемым веществом и продуктом электрохимической реакции. Электролиз ведут в растворе, содержащем большой избыток посторонних ионов, которые также способны к электрохимическому превращению; таким приемом устраняют нежелательные побочные реакции, главная из которых – разложение воды.
Рассмотрим кулонометрическое йод-йодидное биамперометрическое титрование тиосульфата натрия. Схема установки для кулонометрического титрования:
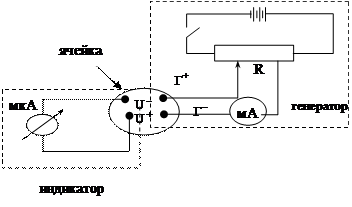 Г+ – основной генераторный электрод (нержавеющая сталь); Г– – вспомогательный генераторный электрод (нержавеющая сталь); U– – основной индикаторный катод (стеклоуглерод); U+ – вспомогательный индикаторный электрод (нихромовая проволока); мкА – микроамперметр индикаторной цепи; мА – миллиамперметр контроля генераторного тока; R – регулятор задания генераторного тока.
Г+ – основной генераторный электрод (нержавеющая сталь); Г– – вспомогательный генераторный электрод (нержавеющая сталь); U– – основной индикаторный катод (стеклоуглерод); U+ – вспомогательный индикаторный электрод (нихромовая проволока); мкА – микроамперметр индикаторной цепи; мА – миллиамперметр контроля генераторного тока; R – регулятор задания генераторного тока.
|
|
|
Проведение йодометрического титрования.
Титрат – тиосульфат натрия, титрант – йод. Исследуемый раствор восстановителя (Na2S2О3) вводят в раствор калий йодида, в который помещают четырех электродную ячейку. Включают одновременно секундомер и ток в генераторной цепи. На генераторном аноде продуцируется титрант по реакции: 2I––2e=I2 или, учитывая комплексообразование
2I– + КI – 2e = КI3. На генераторном катоде происходит выделение водорода при разложении воды (электролиз): 2НОН+2е=Н2+2ОН–. Образующийся молекулярный йод химически реагирует с титратом по закону эквивалентов. А количество образовавшегося йода можно определить по закону Фарадея:  , где n – количество йода (моль); Q – количество электричества, прошедшего через раствор, равно произведению силы тока (I,А) на время (t, сек.); z – число электронов, участвующих в элементарном акте электрохимической реакции; F – постоянная Фарадея (96485 Кл/моль). Для тиосульфата z = 1. До тех пор, пока в растворе существует восстановитель (титрат), образующийся в результате генерации йод моментально реагирует с ним, поэтому в индикаторной цепи ток практически не идет. После того, как весь титрат прореагирует, йод появляется в растворе. С этого момента на индикаторном катоде (стеклоуглерод) пойдет реакция: I2 +2e=2I – или КI3+2e= КI + 2I –. При этом микроамперметр начнет показывать изменения тока и в этот момент необходимо остановить секундомер. Появление тока в индикаторной цепи свидетельствует о достижении точки эквивалентности. На индикаторном аноде происходит растворение нихромовой проволоки. При несвоевременном выключении установки, рабочий раствор может быть перетитрован.
, где n – количество йода (моль); Q – количество электричества, прошедшего через раствор, равно произведению силы тока (I,А) на время (t, сек.); z – число электронов, участвующих в элементарном акте электрохимической реакции; F – постоянная Фарадея (96485 Кл/моль). Для тиосульфата z = 1. До тех пор, пока в растворе существует восстановитель (титрат), образующийся в результате генерации йод моментально реагирует с ним, поэтому в индикаторной цепи ток практически не идет. После того, как весь титрат прореагирует, йод появляется в растворе. С этого момента на индикаторном катоде (стеклоуглерод) пойдет реакция: I2 +2e=2I – или КI3+2e= КI + 2I –. При этом микроамперметр начнет показывать изменения тока и в этот момент необходимо остановить секундомер. Появление тока в индикаторной цепи свидетельствует о достижении точки эквивалентности. На индикаторном аноде происходит растворение нихромовой проволоки. При несвоевременном выключении установки, рабочий раствор может быть перетитрован.
Способы многократного проведения титрования в одном и том же растворе:
|
|
|
1) подкисление рабочего раствора до рН=4–5; 2) устранение йода путем адсорбции углем; 3) изоляция раствора вблизи генераторного катода, на котором происходит защелачивание.
Точность метода – 2 %. Определяемые абсолютные количества веществ в обычных установках 10–6 – 10–5 моль эквивалентов. Биамперометрический – метод индикации двумя электродами. Кулонометрический анализ благодаря своей высокой чувствительности и простоте используется для анализа микроконцентраций веществ в сточных водах, в оборотных промышленных водах, для контроля атмосферы и т.д.
|
|
|
|
|
Дата добавления: 2017-01-13; Просмотров: 445; Нарушение авторских прав?; Мы поможем в написании вашей работы!