
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типы связей между структурными частицами вещества
|
|
|
|
Различают следующие типы связи между структурными частицами вещества (ионы, молекулы): ковалентная, ионная, металлическая и межмолекулярная (рис. 1.10.)








Рис. 1.10. Типы связей между структурными частицами вещества
Рассмотрим некоторые понятия.
Электроотрицательность атома ЭО определяется как:
ЭО = W и + W с,
где W и – энергия ионизации, W с – сродство к электрону.
Энергия ионизации – количество энергии, которое нужно затратить, чтобы превратить нейтральный атом в положительно заряженный ион.
Сродство к электрону - количество энергии, которое выделяется при присоединении электрона к нейтральному атому, то есть при превращении его в отрицательный ион.
Дипольный момент μ оценивает степень полярности молекул:
μ = | q |· l, Кл·м, (1)
где | q |·- абсолютная величина заряда, Кл; l – расстояние между центрами положительных и отрицательных зарядов, м.
Если l = 0, то есть центры положительных и отрицательных зарядов в молекуле находятся в одной точке, то молекула называется неполярной ( μ = 0).
Если l > 0, то есть центры положительных и отрицательных зарядов в молекуле не совпадают, то молекула называется полярной или дипольной или просто «диполем» ( μ > 0).
Соответственно, вещества, состоящие из полярных молекул, называются полярными, а вещества, состоящие из неполярных молекул – неполярными.
Ковалентная связь
Ковалентная связь образуется путем обобществления валентных электронов двух или более одинаковых или разнородных атомов.
Полярная ковалентная связь образуется при объединении в молекулу двух или более атомов различных химических элементов. Объединение сопровождается смещением электронной плотности (вероятности нахождения электрона в данной точке пространства δ) в сторону более электроотрицательного атома с образованием дипольного момента. При этом межъядерное пространство имеет отрицательный заряд, а атомные остовы – положительный. Взаимодействие указанных зарядов создает устойчивую кристаллическую или аморфную структуру материала.
|
|
|
Полярная ковалентная связь образуется в молекуле воды (рис.1.5), в карбидах (Fe3C, SiC и др.), нитридах (AlN и др.).
Неполярная ковалентная связь образуется при объединении в молекулу одинаковых атомов, например, при образовании молекулы водорода (рис.16.6).

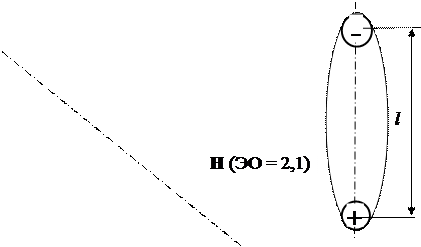
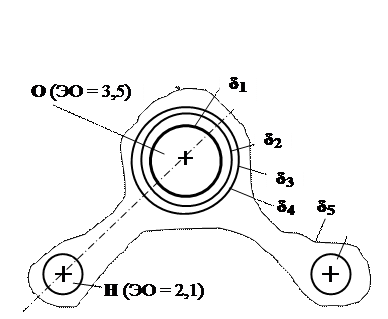
Рис. 16.5. Строение полярной молекулы воды:
δi – электронная плотность, δ1 > δ2 > δ3
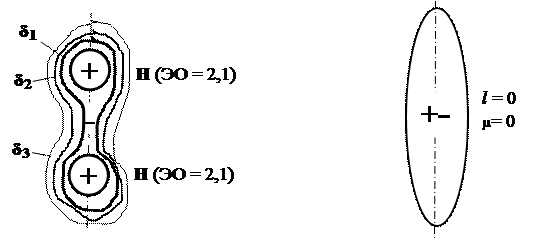 |
Рис. 16.6. Строение неполярной молекулы водорода:
δ1 > δ2 > δ3
Ионная связь
Ионная связь образуется за счет преимущественного смещения электронной плотности валентных электронов взаимодействующих атомов в сторону более электроотрицательного атома.
При формировании ионной связи образуются разноименно заряженные ионы, которые, притягиваясь друг к другу, создают устойчивую ионную кристаллическую решетку или аморфную структуру. Ионная связь реализуется, например, в кристаллах NaCl (рис. 16.7). На рис. 16.7 приведены изолинии электронной плотности. Большая толщина линий соответствует большей электронной плотности.
|
|
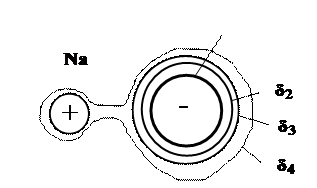
Рис. 16.7. Ионная связь в NaCl: δ1> δ2> δ3> δ4
Металлическая связь
Металлическая связь заключается в обобществлении валентных электронов всех атомов металла с образованием так называемого электронного газа или электронов проводимости.
Металл состоит из положительных ионов, расположенных в пространстве в определенном порядке и совершающих непрерывные хаотические тепловые колебательные движения около положения равновесия (фононы) и электронного газа (рис.16.8).
|
|
|
Взаимодействие электронного газа, имеющего отрицательный заряд, и положительных ионов приводит к образованию устойчивой кристаллической решетки металла. Электронная плотность примерно одинакова в любой точке межионного пространства. Валентные электроны слабо связаны с ионами, могут свободно перемещаться по объему вещества под действием электрического поля. Поэтому вещества с металлической связью являются проводниками.
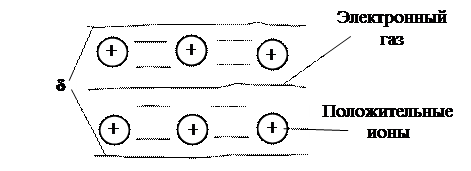
Рис. 16.8. Схема металлической связи в кристалле металла
Межмолекулярная связь
Межмолекулярная связь обусловлена силами межмолекулярного притяжения (силами Ван-дер–Ваальса) между молекулами.
Межмолекулярные силы имеют электрическую природу и являются результатом одновременного действия трех эффектов – ориентационного, индукционного и дисперсионного. Энергия межмолекулярного взаимодействия определяется как:
Е = Е о+ Е и+ Е д,
где Е о, Е и, Е д - энергииориентационного, индукционного и дисперсионного взаимодействий, соответственно.
Ориентационное притяжение (постоянный диполь - постоянный диполь) осуществляетсямежду молекулами, имеющими постоянный дипольный момент
m = |q|· r,
где |q| - модуль заряда диполя, r – расстояние между центрами положительного и отрицательного зарядов диполя. Энергия взаимодействия Е о ~ r -1.
Индукционное притяжение (постоянный диполь – наведенный индуцированный диполь) возникает между полярной и неполярной молекулами при условии, что последняя способна поляризоваться под действием постоянного диполя. Энергия взаимодействия Е и ~ r - 6.
Дисперсионное притяжение (мгновенный диполь – наведенный индуцированный диполь). В неполярных молекулах в результате случайных флуктуаций электронной плотности возникают мгновенные диполи, индуцирующие диполи в соседних неполярных молекулах. Энергия такого взаимодействия Е д ~ r - 6.
Особым типом межмолекулярного взаимодействия является водородная связь – связь между катионом водорода одной молекулы и анионом другой молекулы, например, N-3, О-2, F-1. Природа водородной связи двояка: c одной стороны – это диполь-дипольное взаимодействие, а с другой – донорно-акцепторное взаимодействие между электронами электроотрицательного атома и электроном атома водорода.
|
|
|
Межмолекулярная связь реализуется в низкомолекулярных веществах, например, в воде, парафине, и в высокомолекулярных веществах – органических и неорганических полимерах. Вещества молекулярного строения, главным образом, диэлектрики.
Вещества с ковалентной, ионной и межмолекулярными связями являются диэлектриками или полупроводниками, вещества с металлической связью – проводниками.
В материалах, как правило, реализуются одновременно несколько типов связей, а их количественная оценка имеет вероятностный характер. Например, в кристалле железа вероятность нахождения валентных электронов в виде электронного газа (вероятность металлической связи) составляет 55 %, а вероятность обобществления валентных электронов несколькими атомами (вероятность ковалентной связи) – 45 %.
|
|
|
|
|
Дата добавления: 2017-01-13; Просмотров: 2417; Нарушение авторских прав?; Мы поможем в написании вашей работы!