
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Элементов Д.И. Менделеева
|
|
|
|
Периодическая система
Элементов Д.И. Менделеева
Константы и степени диссоциации некоторых слабых электролитов
| Электролиты | Формула | Числовые значения констант диссоциации | Степень диссоциации в 0,1 н. растворе, % |
| Азотистая кислота | HNO2 | К = 4,0 × 10-4 | 6,4 |
| Аммиак (гидроксид) | NH4OY | К = 1,8 × 10-5 | 1,3 |
| Муравьиная кислота | HCOOH | К = 1,76 × 10-4 | 4,2 |
| Ортоборная кислота | H3BO3 | К1 = 5,8 × 10-10 К2 = 1,8 × 10-13 К3 = 1,6 × 10-14 | 0,007 |
| Ортофосфорная кислота | H3PO4 | К1 = 7,7 × 10-3 К2 = 6,2 × 10-8 К3 = 2,2 × 10-13 | |
| Сернистая кислота | H2SO3 | К1 = 1,7 × 10-2 К2 = 6,2 × 10-8 | 20,0 |
| Сероводородная кислота | H2S | К1 = 5,7 × 10-8 К2 = 1,2 × 10-15 | 0,07 |
| Синильная кислота | HCN | К = 7,2 × 10-10 | 0,009 |
| Угольная кислота | H2CO3 | К1 = 4,3 × 10-7 К2 = 5,6 × 10-11 | 0,17 |
| Уксусная кислота | CH3COOH | К = 1,75 × 10-5 | 1,3 |
| Фтороводородная кислота | HF | К = 7,2 × 10-4 | 8,5 |
| Хлорноватистая кислота | HClO | К = 3,0 × 10-8 | 0,05 |
Таблица 10. Периодическая система

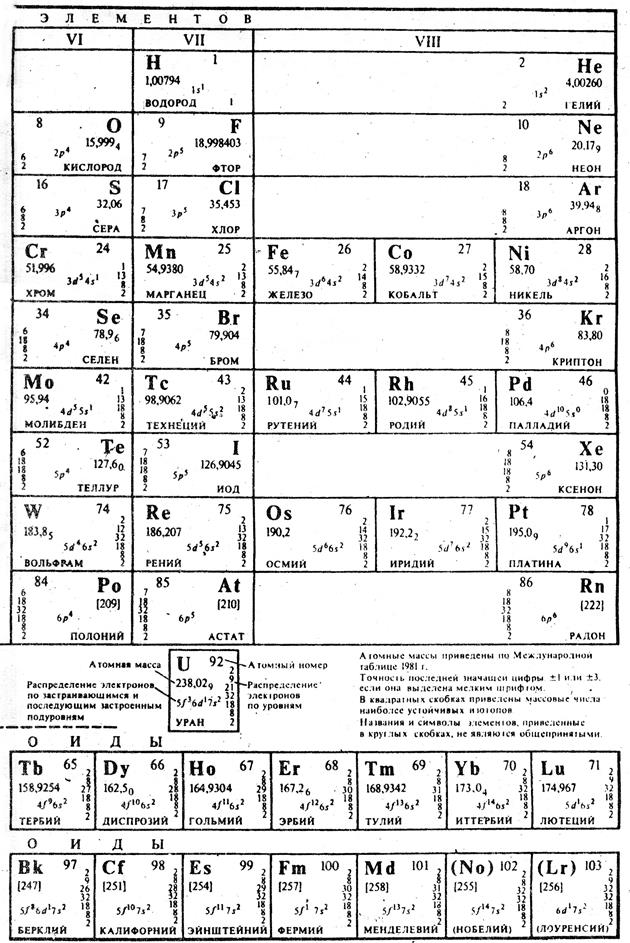
Таблица 11. (вариант

длинной формы)
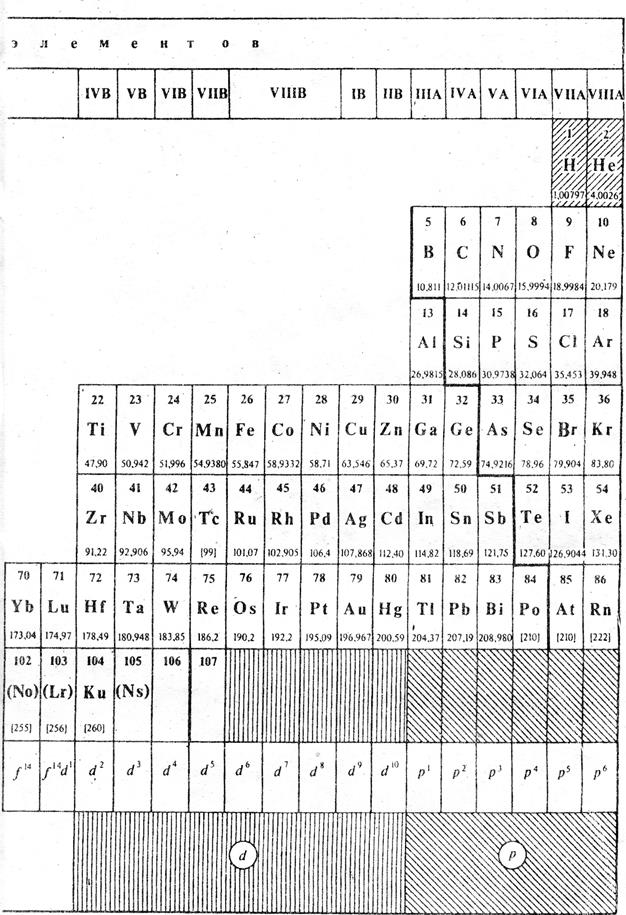
 Таблица 12.
Таблица 12.
Растворимость солей и оснований в воде (Р – растворимое, М – малорастворимое,
Н – практически нерастворимое вещество, прочерк означает, что вещество
не существует или разлагается водой)
| Анионы | Катионы | ||||||||||||||||||
| Li+ | Na+, K+ | NH+4 | Cu2+ | Ag+ | Mg2+ | Ca2+ | Sr2+ | Ba2+ | Zn2+ | Hg2+ | Al3+ | Sn2+ | Pb2+ | Bi3+ | Cr3+ | Mn2+ | Fe3+ | Fe2+ | |
| Cl– | Р | Р | Р | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | – | Р | Р | Р | Р |
| Br– | Р | Р | Р | Р | Н | Р | Р | Р | Р | Р | М | Р | Р | М | – | Р | Р | Р | Р |
| I– | Р | Р | Р | – | Н | Р | Р | Р | Р | Р | Н | Р | Р | Н | – | Р | Р | – | Р |
| NO–3 | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | – | Р | Р | Р | – | Р | Р |
| CH3COO– | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | – | Р | – | – | Р | – | Р |
| S2– | Р | Р | Р | Н | Н | – | Р | Р | Р | Н | Н | – | Н | Н | Н | – | Н | Н | Н |
| SO2–3 | Р | Р | Р | Н | Н | Н | Н | Н | Н | Н | Н | – | – | Н | Н | – | Н | – | Н |
| SO2–4 | Р | Р | Р | Р | М | Р | М | Н | Н | Р | – | Р | Р | Н | – | Р | Р | Р | Р |
| CO2–3 | Р | Р | Р | – | Н | Н | Н | Н | Н | Н | – | – | – | Н | Н | – | Н | – | Н |
| SiO2–3 | Р | Р | – | – | – | Н | Н | Н | Н | Н | – | Н | – | Н | – | – | Н | Н | Н |
| Cr2–4 | Р | Р | Р | Н | Н | Р | М | М | Н | Н | Н | – | – | Н | Н | Р | Н | – | – |
| PO3–4 | Н | Р | Р | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| OH– | Р | Р | Р | Н | – | Н | М | М | Р | Н | – | Н | Н | Н | Н | Н | Н | Н | Н |
|
|
|
Таблица 13.
Основные классы неорганических веществ
| Вещества | Классификация веществ | П р и м е р ы | |
| Простые | Металлы (85 элементов) | s-элементы p-элементы Al, Ga, In, Ti, Ge, Sn, Bi. d-элементы f-элементы | |
| Неметаллы (22 элемента) | s-элементы (Н, Не) p-элементы B, C, Si, N, P, O, S, Se, Te галогены благородные газы | ||
| Сложные | Бинарные соединения | гидриды карбиды нитриды оксиды сульфиды галиды | LiH, NaH, CaH2, BaH2 Be2C, CaC2, Al4C3 Na3N, Mg3N2, Si3N4 Na2O, CaO, Al2O3 K2S, ZnS, Fe2S3 NaCl, BaCl2, FeCl3 |
| Соли | Средние кислые (гидро-) основные (гидроксо-) | NaNO3, Al2(SO4)3, K3PO4 NaHSO4, KH2PO4, Ca(H2PO4)2 MgOHCl, (CuOH)2SO4, Fe(OH)2Cl | |
| Гидроксиды | кислоты амфолиты (амфотерные) основания | HNO3, H2SO4, H3PO4 Zn(OH)2, Al(OH)3, Be(OH)2 H2ZNO2, H3AlO3, H2BeO2 KOH, Ba(OH)2, Ni(OH)3 |
Взаимосвязь простых веществ, оксидов, оснований и кислот
(реакции солеобразования)
1. Металл + кислота ® соль + водород
Fe + 2HCl = FeCl2 + H2
2. Металл + неметалл ® соль бескислородной кислоты
2Fe + 3Cl2 = 2FeCl3
3. Металл (1) + соль (1) ® соль (2) + металл (2)
Fe + CuCl2 = FeCl2 + Cu
4. Основной оксид + кислотный оксид ® соль
BaO + SO3 = BaSO4
5. Основной оксид + кислота ® соль + вода
BaO + 2HCl = BaCl2 + H2O
6. Основание + кислота ® соль + вода (реакция нейтрализации)
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
7. Основание + кислотный оксид ® соль + вода
Ba(OH)2 + SO3 = BaSO4 + H2O
8. Основание (1) + соль (1) ® соль (2) + основание (2)
Ba(OH)2 + K2SO4 = BaSO4 + 2KOH
9. Соль (1) + кислота (1) ® соль (2) + кислота (2)
BaCl2 + H2SO4 = BaSO4 + 2HCl
10. Соль (1) + соль (2) ® соль (3) + соль (4)
BaCl2 + K2SO4 = BaSO4 + 2KCl
Оглавление
ОБЩИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ.. 3
ПРОГРАММА.. 5
ЛИТЕРАТУРА.. 12
КОНТРОЛЬНЫЕ ЗАДАНИЯ.. 12
КОНТРОЛЬНОЕ ЗАДАНИЕ 1. 12
|
|
|
КОНТРОЛЬНОЕ ЗАДАНИЕ 2. 34
Таблица вариантов контрольных заданий.. 59
Приложение.. 64
|
|
|
|
|
Дата добавления: 2017-01-13; Просмотров: 265; Нарушение авторских прав?; Мы поможем в написании вашей работы!