
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Структура периодической системы
|
|
|
|
В результате длительной и напряженной научной работы Д.И. Менделеевым была создана таблица – прообраз современной периодической таблицы элементов.
При построении периодической таблицы Д.И. Менделеев оставил многие клетки свободными. Оставив пустые клетки, он тем самым показал, что должны существовать элементы, которые пока не известны. Для некоторых из них он подробно описал свойства. Предсказания Д.И. Менделеева в последующем получили блестящее подтверждение.
Периодическая система элементов является графическим изображением периодического закона. Существует более 400 вариантов таблицы периодической системы элементов.
Наиболее распространенными формами периодической системы является короткая и длинная.
Каждый из этих вариантов имеет свои преимущества и недостатки. Так, существенным недостатком короткой формы является сочетание в одной группе несходных элементов. Недостатком длинной формы, в которой элементы размещены по семействам, - растянутость, некомпактность.
Наиболее общепринятой является короткая форма таблицы. Она состоит из периодов, рядов, групп и подгрупп. По горизонтали имеются семь периодов, из них первые три называются малыми, а остальные – большими. Элементы 2-го и 3-го периодов называются типическими.
Период – это последовательный ряд химических элементов, атомы которых имеют одинаковое число энергетических уровней и расположены в порядке возрастания зарядов их ядер. Число заполняемых энергетических уровней (электронных слоёв) в атомах элементов данного периода равно номеру периода. При этом номер периода элемента совпадает со значением главного квантового числа n внешнего слоя. Число элементов в периоде определяется следующими формулами:
|
|
|
Для нечетных периодов:
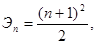
для чётных периодов:

где Э – число элементов в периоде; n – номер периода.
Эти формулы позволяют легко определить, что в 1-ом периоде должно содержаться 2 элемента, во 2-ом и 3-м – по 8, в 4-м и 5-м – по 18, в 6-м – 32, в незавершённом 7-м периоде также должно быть 32 элемента.
Все периоды начинаются с s -элементов (типичных металлов). Заканчиваются периоды атомами инертных элементов, у которых (кроме He) на внешнем электронном слое находится восемь электронов (электронный октет) – это максимальное число электронов на внешнем слое. Такой внешний электронный слой называется завершённым. Электронная структура атома инертного элемента данного периода является остовом, т. е. основой для построения электронной конфигурации атомов элементов последующего периода. Поэтому отчетливо проявляется периодичность в изменении электронной структуры атомов. Однако в этой периодичности нет простого повторения. Структура остова от периода к периоду изменяется, его конфигурация усложняется, что существенным образом влияет на химические свойства каждого элемента периода.
В периодической системе десять рядов. Каждый малый период состоит из одного ряда, каждый большой период – из двух рядов: чётного (верхнего) и нечётного (нижнего). 7-й период пока состоит из одного ряда элементов. Все элементы в ряду пронумерованы в порядке возрастания зарядов ядер их атомов. Номера элементов называются порядковыми, или атомными номерами.
Группа – это совокупность элементов, атомы которых имеют, как правило, одинаковое количество валентных электронов, но различаются между собой числом застраиваемых энергетических уровней и структурой своих атомных остовов. В периодической системе восемь групп расположены по вертикали. Номер группы определяет собой максимальную валентность элемента в оксидах и в других соединениях. Есть исключения: для I группы Cu имеет высшую валентность II, Ag и Au – III; для VI группы О имеет валентность II; для VII группы Н и F имеют валентность I; для VIII группы только Ru и Os имеют высшую валентность VIII.
|
|
|
Каждая группа состоит из двух подгрупп: главной и побочной.
Главная подгруппа – это вертикальный ряд элементов, атомы которых на внешнем электронном слое имеют одинаковое число электронов, равное номеру группы. Главные подгруппы включают в себя элементы малых и больших периодов. Главных подгрупп восемь.
Элементы, которые находятся в одной подгруппе, являются элементами-аналагами, так как они имеют некоторые общие свойства. Эти общие свойства объясняются одинаковым строением внешнего электронного слоя. В главных подгруппах I и II групп размещаются s -элементы, а в главных подгруппах III – VIII групп – р -элементы.
Побочная подгруппа – это вертикальный ряд d -элементов, атомы которых имеют одинаковое суммарное число электронов на d -подуровне предвнешнего слоя и s- подуровне внешнего слоя, равное номеру группы. Побочных подгрупп десять. Различие главных и побочных подгрупп подчеркивается смещением одних вправо, других – влево.
У элементов побочных подгрупп (переходных элементах) наблюдается аналогия в строении внешнего и предвнешнего уровней. Валентные электроны в атомах d- элементов расположены на этих двух энергетических уровнях.
В химических реакциях d- элементы участвуют только как доноры электронов. В связи с этим их окислительные числа положительны. В качестве акцепторов электронов d- элементы не выступают.
|
|
|
|
|
Дата добавления: 2017-01-13; Просмотров: 801; Нарушение авторских прав?; Мы поможем в написании вашей работы!