
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кинетические уравнения гомогенных химических реакций
|
|
|
|
Химическая реакция, протекающая в пределах одной фазы, называется гомогенной.
Скоростью гомогенной химической реакции по данному i -му веществу v называется изменение количества этого вещества ni (в молях) в единицу времени t в единице объема:
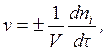 (4.1)
(4.1)
где V – объем (реакционное пространство), л.
Если объем системы во время реакции не меняется, то его можно внести под знак дифференциала, при этом
 (4.2)
(4.2)
Тогда вместо (4.1) получим
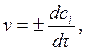 (4.3)
(4.3)
где ci – концентрация рассматриваемого i -го вещества в данный момент времени (моль/л). Таким образом, для гомогенного химического процесса, идущего при постоянном объеме, скоростью процесса по некоторому i-му веществу называется изменение концентрации i-го вещества в единицу времени. Размерность скорости в этом случае равна моль/(л×с) или моль/(л×мин). Так как скорость химической реакции – это величина положительная, то в формуле (4.3) знак плюс используют, если скорость определяют по изменению концентрации продукта реакции (dc > 0), а знак минус – если скорость оценивается по убыли исходного вещества (dc < 0). Скорость химической реакции, выраженная как производная от концентрации по времени, является истинной. Если известны концентрации вещества с1 и с2 в моменты времени τ1 и τ2, соответственно, то можно записать выражение для средней скорости химической реакции в данном интервале времени Δτ = τ2 – τ1:
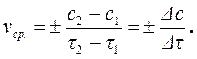 (4.4)
(4.4)
Зависимость скорости реакции от концентрации описывается основным постулатом химической кинетики – законом действующих масс (ЗДМ), установленным Гульдбергом и Вааге в 1867 году: при постоянной температуре скорость односторонней химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в соответствующих степенях.
|
|
|
Если в системе протекает химическая реакция
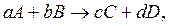 (4.5)
(4.5)
где a, b, c, d – стехиометрические коэффициенты, то ЗДМ для данной реакции записывается следующим образом:
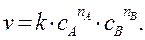 (4.6)
(4.6)
Зависимость скорости реакции от концентрации называется кинетическим уравнением. Это уравнение устанавливается на основе экспериментальных данных о зависимостях концентраций реагирующих веществ от времени с = f(τ), которые могут быть представлены графически в виде кинетических кривых.
Коэффициент пропорциональности k в уравнении (4.6) называется константой скорости химической реакции. По физическому смыслуk равна самой скорости, когда концентрация каждого из реагирующих веществ равна единице. Константа скорости зависит от всех факторов, которые влияют на скорость реакции, за исключением концентрации реагирующих веществ и времени. Численное значение k зависит также от выбора единиц измерения времени и концентрации. Размерность ее определяется тем кинетическим уравнением, по которому ведется ее расчет, то есть зависит от значений показателей степеней при концентрациях реагентов.
Каждый из показателей степени при концентрациях (в данном случае, nA и nB) выражает частный порядок реакции по i -му компоненту. Общим порядком реакции называется сумма показателей степеней при концентрациях в кинетическом уравнении (сумма частных порядков):
 (4.7)
(4.7)
Для характеристики скорости реакции, наряду с константой скорости, часто пользуются временем полупревращения или полураспада (t1/2), равным промежутку времени, в течение которого реагирует половина взятого количества вещества.
В химической кинетике принято все реакции классифицировать по их порядку и по молекулярности.
Молекулярность реакции определяется числом молекул (одинаковых или различных), при одновременном взаимодействии между которыми совершается элементарный акт химического превращения.
|
|
|
Например, реакция
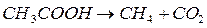 (4.8)
(4.8)
мономолекулярная, а реакция
 (4.9)
(4.9)
бимолекулярная. Молекулярность реакции – всегда целое положительное число: 1, 2, реже 3.
Порядок химической реакции определяется по виду кинетического уравнения, выражающего зависимость скорости реакции от концентрации реагирующих веществ, устанавливаемому на основе экспериментальных данных. Для простых (элементарных) реакций, проходящих в одну стадию, механизм реакции соответствует химическому уравнению. В этом случае порядок химических реакций совпадает с молекулярностью и равен сумме стехиометрических коэффициентов в уравнении n = a + b. Порядки могут принимать целые, дробные, отрицательные значения, а также быть равными нулю.
Порядок реакции может быть понижен, если какой-либо из реагентов берется в большом избытке. В этом случае его концентрация в соответствующей степени при прохождении химической реакции остается постоянной величиной и может быть включена в константу скорости химической реакции, которая в этом случае приобретает новое значение. Например, при избытке компонента В в реакции (4.5) кинетическое уравнение приобретает вид
 , (4.10)
, (4.10)
где  .
.
В этом случае общий порядок реакции становится равным nA и носит название псевдопорядка.
Порядки химических реакций определяют на основе экспериментальных кинетических данных. Методы определения порядков химических реакций (метод подстановки, графический метод, по периоду полупревращения, метод Оствальда-Нойеса) описаны, например, в учебном пособии [9].
Кинетические уравнения применяются для расчета скорости химической реакции, определения констант скоростей химических реакций, концентраций реагентов в заданные моменты времени, продолжительности процесса для достижения необходимой концентрации реагирующих веществ, для оценки времени (периода) полупревращения. Уравнения, позволяющие производить данные расчеты, получены после интегрирования кинетических уравнений различного порядка. В табл. 4.1 приведены основные кинетические уравнения и формулы для расчета констант скоростей, текущих концентраций, времени полупревращения для реакций нулевого, первого, второго и третьего порядков для случая, когда исходные концентрации реагирующих веществ равны между собой.
|
|
|
П р и м е р 4.1. В реакции первого порядка за время 20 минут превратилось 65,5 % исходного вещества. Определить константу скорости данной реакции.
Р е ш е н и е
Пусть исходная концентрация вещества Со, тогда концентрация данного реагента в момент времени τ = 20 минут:
С = Со · (100 – 65,5) / 100 = 0,345 Со.
Расчет константы скорости реакции первого порядка рассчитывается по уравнению:

Таблица 4.1
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 942; Нарушение авторских прав?; Мы поможем в написании вашей работы!