
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства
1. Карбоновые кислоты образуют соли:
cоли кислот от С11 и выше называются мылами:

Карбоновые кислоты – это слабые кислоты, но способны вытеснять угольную кислоту из ее солей:

2. Основные свойства карбоновых кислот

3. Образование амидов:

Амиды - кристаллические вещества (кроме формамида НСОNН2).
4. Образование галогенангидридов кислот с помощью РCl5, PCl3, SOCl2:

5. Реакция S – ацилирования тиолов

6. Реакция этерификации; образование сложных эфиров

Механизм реакции:

7. Образование ангидридов:

Ангидриды кислот характеризуются большой активностью, являются ацилирующими агентами.
8. Распад карбоксильной группы
а) пиролиз солей щелочных металлов

г) Декарбонилирование муравьиной кислоты:

9. α-Галогенирование; в этой реакции проявляются электроноакцепторные свойства карбоновых кислот:

Hal: Cl, Br, I, F.
10. Восстановление до соответствующих альдегидов и первичных спиртов:
R – COOH 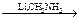 R – CH=N – CH3
R – CH=N – CH3 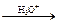 R – CHO
R – CHO
11. Окисление
HCOOH + HgCl2 → Hg + CO2 + 2HCl
HCOOH + 2[Ag(NH3)2]OH → 2Ag + NH4HCO3 + 3NH3 + H2O
HCOOH + Cl2 → CO2 + 2HCl
12. Некоторые специфические свойства ненасыщенных кислот, реакции в углеводородном остатке
| а) | 
|
| б) | 
|
§5. Применение:
Муравьиная кислота – как консервант в пищевой промышленности, в текстильном и кожевенном производстве. Эфиры и амиды муравьиной кислоты используют в качестве растворителей.
Уксусная кислота – как консервант и вкусовая приправа в пищевой промышленности (3 – 6% - ный раствор уксусной кислоты называется «столовым уксусом»). Чистая уксусная кислота называется «ледяной», т.к. кристаллизуется уже при 16,60С.
Основная часть уксусной кислоты расходуется на производство искусственных волокон на основе целлюлозы (ацетатный шелк).
Эфиры уксусной кислоты применяют в качестве растворителей лаков, красок.
Соли (ацетат свинца, ацетат алюминия), эфиры (ацетилсалициловая кислота, бисакодил) и амиды (фенацетин, парацетамол) применяют в качестве лекарственных препаратов.
Высшие карбоновые кислоты входят в состав жиров, масел, липидов.
|
|
Дата добавления: 2017-02-01; Просмотров: 70; Нарушение авторских прав?; Мы поможем в написании вашей работы!