
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Экспериментальная часть
|
|
|
|
Опыт № 1. Диссоциация карбоновых кислот.
В три пробирки поместить по 3–4 капли следующих кислот: муравьиную, щавелевую, янтарную. К каждой кислоте прилить по 1 капле универсального индикатора. Сравнить окраску растворов с универсальной шкалой рН. Сделать вывод о силе исследуемых кислот и подтвердить его электронными эффектами, присутствующими в каждой из кислот. Написать уравнение диссоциации.
Опыт № 2. Получение муравьиной кислоты из хлороформа и ее открытие.
В пробирке 1 приготовить аммиачный раствор гидроксида серебра – реактива для обнаружения муравьиной кислоты. Для этого к 1 капле 0,2 N AgNO3 прибавить 1 каплю раствора NaOH. Образовавшийся осадок гидорксида серебра растворить, прибавив 2 капли 5 % NH4OH и 2 капли воды.
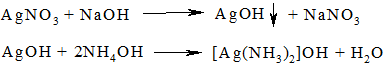
В пробирку 2 поместить 1 каплю хлороформа и 3 капли раствора NaOH. Осторожно нагреть пробирку на горелке до исчезновения запаха хлороформа:

Образовавшийся формиат натрия открыть с помощью реактива, приготовленного в пробирке 1 для этого содержимое пробирки 1 слить в пробирку 2. Серебро немедленно восстанавливается в виде черного осадка:

Опыт № 3. Реакция с карбонатом натрия.
Карбоновые кислоты вытесняют из карбонатов натрия диоксид углерода как обычные минеральные кислоты. В две пробирки налить по 2 мл 5 % раствора карбоната натрия и добавить одну из них муравьиную или уксусную кислоту, а в другую – щавелевую. Наблюдается выделение пузырьков газа. Напишите уравнение реакции.
Опыт № 4. Свойства непредельных жирных кислот.
В пробирку поместить 5 капель концентрированного раствора мыла и добавить одну каплю 2N H2SO4. Выпадает белый хлопьевидный маслянистый осадок свободных жирных кислот. Добавить в пробирку 2–4 капли бромной воды. Наблюдается ее обесцвечивание. Объясните происходящее явление. Напишите уравнение кислого гидролиза натриевых солей малеиновой и олеиновой кислот и реакцию присоединения к ним брома.
|
|
|
Опыт № 5. Открытие уксусной кислоты. Получение комплексной железной соли и разложение ее при кипячении.
Поместить в пробирку несколько крупинок ацетата натрия и убедиться в том, что он не имеет запаха. Добавить в пробирку 3 капли воды и 2 капли 0,1N FeCl3. Появляется желто-красное окрашивание от образовавшейся железной соли уксусной кислоты – ацетата железа (запишите уравнение реакции). Подогреть раствор до кипения. Немедленно происходит гидролиз железной соли. Выделяется красно-бурый осадок нерастворимого в воде ацетат железа.
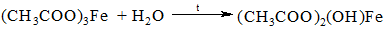
Отстоявшийся над ним раствор, не содержащий ионов Fe³ становится бесцветным. Описанную реакцию применяют в качественном анализе для удаления оксида железа (III) из раствора. Эту реакцию можно провести со свободной уксусной кислотой, предварительно нейтрализовав ее (контроль индикаторной бумагой).
Опыт № 6. Открытие щавелевой кислоты в виде кальциевой соли.
С помощью пипетки нанести каплю щавелевой кислоты на предметное стекло или в пробирку. Добавить одну каплю 0,5N CaCl2. Что вы наблюдаете? Прибавьте к осадку 1 каплю 2N CH3COOH – осадок не растворяется. От прибавления 1–2 капель HCl осадок растворится полностью. Объясните эту характерную особенность оксалата кальция путем сравнения силы этих кислот: щавелевой, уксусной и соляной.
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 298; Нарушение авторских прав?; Мы поможем в написании вашей работы!