
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Разбавленные растворы
|
|
|
|
Идеальные растворы подчиняются закону Рауля при всехконцентрациях. Разбавленные растворы также подчиняются закону Рауля, поскольку при малых концентрациях расстояния между частицами растворённого вещества велики и силы взаимодействия между ними стремятся к нулю. Очевидно, что в этом случае природа растворённого вещества не имеет значения. Свойства раствора, которые не зависят от природы растворённого вещества, а определяются числом частиц растворенного вещества, называются коллигативными свойствами. К ним относятся понижение давления пара над растворами (закон Рауля), повышение температуры кипения раствора, понижение температуры замерзания раствора и осмотическое давление раствора. На рис. 3.3 показана взаимосвязь коллигативных свойств разбавленных растворов нелетучих веществ: понижение давления пара над раствором, повышение температуры кипения и понижение температуры замерзания.

Рис. 3.3. Зависимость давления пара над растворителем и раствором от температуры
Температура кипения разбавленного раствора, содержащего нелетучее вещество, выше температуры начала кипения растворителя, причём повышение температуры кипения пропорционально концентрации растворенного вещества:
 , (3.19)
, (3.19)
где m 2 – моляльная концентрация растворенного вещества, E – эбуллиоскопическая постоянная (моляльное повышение температуры кипения раствора).
Значение эбулиоскопической постоянной Е зависит от свойств растворителя и определяется по уравнению:
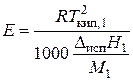 , (3.20)
, (3.20)
где Т кип,1– температура кипения растворителя, Δисп Н 1 – теплота испарения растворителя, М 1 – молярная масса растворителя. Следует помнить, что приведенные уравнения (3.19) и (3.20) справедливы лишь для разбавленных растворов, массовая концентрация которых не превышает ~0,01 %.
|
|
|
Повышение температуры кипения позволяет рассчитать моляльность раствора и отсюда молярную массу растворённого вещества по уравнению
 , (3.21)
, (3.21)
где М 2 – молярная масса растворённого вещества, g 1, g 2 − массы растворителя (1) и растворённого вещества (2).
Температура, при которой в условиях равновесия из жидкого раствора начинают появляться кристаллы твердой фазы, называется температурой начала кристаллизации (замерзания раствора). Если растворённое вещество и растворитель не образуют твёрдого раствора, то из разбавленного раствора выделяются кристаллы растворителя, причём температура кристаллизации из раствора ниже температуры кристаллизации чистого растворителя. Понижение температуры кристаллизации пропорционально концентрации растворённого вещества:
 , (3.22)
, (3.22)
где m 2 – моляльная концентрация растворённого вещества, К − криоскопическая постоянная (моляльное понижение температуры замерзания раствора).
Значение криоскопической постоянной зависит от свойств растворителя и определяется по уравнению:
 , (3.23)
, (3.23)
где Тзам, 1 – температура замерзания растворителя, Δпл Н1 – теплота плавления растворителя, М1 − молярная масса растворителя.
Понижение температуры замерзания позволяет рассчитать моляльность раствора и затем молярную массу растворенного вещества по уравнению:
 , (3.24)
, (3.24)
где М 2– молярная масса растворенного вещества, g 1, g 2 – массы растворителя (1) и растворённого вещества (2).
В разбавленном растворе неэлектролита число частиц совпадает с числом молекул, в то время как в растворе электролита число частиц увеличивается в результате диссоциации. Поэтому для растворов электролитов в уравнения для расчёта коллигативных свойств вводится соответствующая поправка, так называемый изотонический коэффициент Вант-Гоффа i.
|
|
|
 , (3.25)
, (3.25)
где α – степень диссоциации, а ν – число ионов, образующихся из одной молекулы электролита.
Работа 3.2. Определение молярной массы растворенного
вещества криоскопическим методом
Цель работы. Определить молярную массу растворенного вещества криоскопическим методом.
Методика выполнения работы. Криостатом называют прибор, предназначенный для проведения экспериментов при пониженных температурах. В настоящей работе применяется криостат с термоэлектрическим микрохолодильником, общий вид которого представлен на рис. 3.4.

Рис.3.4. Общий вид криостата:
1 – выпрямитель, 2 – микрохолодильник, 3 – шланги с охлаждающей водой, 4 – переключатель тока, 5 – амперметр, 6 – термометр Бекмана
Термоэлектрическое охлаждение основано на эффекте Пельтье: при прохождении электрического тока через контакт двух разнородных проводников в месте контакта в зависимости от направления тока выделяется или поглощается тепло. Таким образом, термоэлемент представляет собой простейшую холодильную установку, перекачивающую тепло с более низкого температурного уровня (холодный спай) на более высокий уровень (горячий спай). Для отвода тепла с горячих спаев термоэлементов служит микрохолодильник 2, охлаждаемый проточной водой (для подачи и слива воды введены два штуцера). Питание микрохолодильника 2 осуществляется от специального выпрямителя (поз. 1), ток нагрузки которого регулируется позиционным переключателем 4 и контролируется амперметром 5.
Перед включением выпрямителя в сеть необходимо проверить исправность шлангов и пустить в микрохолодильник проточную воду. При максимальном токе 30 А микрохолодильник обеспечивает через 1 ч работы перепад температур между дном рабочего стакана и охлаждающей водой не менее 50 0С.
Термометр Бекмана (поз. 6) применяется для измерения разности температур с высокой точностью (цена деления шкалы равна 0,020). Чтобы достичь такой точности, интервал измерений шкалы термометра Бекмана составляет всего 50. С помощью дополнительного верхнего резервуара со ртутью, отбирая или добавляя ртуть в рабочий нижний резервуар, можно «привязать» 5-градусный участок термометра Бекмана к любому интервалу абсолютной шкалы. Эта операция называется настройкой термометра Бекмана.
|
|
|
Чтобы настроить термометр, необходимо привести в соприкосновение ртуть верхнего и нижнего резервуаров. Для этого, подогревая рукой (а если этого недостаточно, то, опустив в теплую воду), вызывают расширение ртути в нижнем резервуаре с тем, чтобы заполнить ею весь капилляр доверху. Затем, быстро перевернув термометр головкой вниз и слегка постукивая по головке, добиваются того, чтобы ртуть в верхнем резервуаре подошла вплотную к верхушке капилляра, наполненного ртутью из нижнего резервуара, и слилась с ней. После этого термометр осторожно возвращают в прежнее вертикальное положение. Нижний резервуар с ртутью тотчас погружают в заранее подготовленный стакан с водой, температура которого должна равняться температуре замерзания чистого растворителя. Металлическую головку термометра зажимают в штативе. Термометр не должен касаться стенок стакана и опираться на дно. Размешивая воду палочкой и добавляя в неё небольшие кусочки льда, в течение 3-5 мин поддерживают её температуру постоянной. При этом ртуть нижнего резервуара, охлаждаясь, сжимается и, будучи слита с ртутью верхнего резервуара, перетягивает недостающее количество ртути из верхнего резервуара в нижний. Через 5 мин, освободив из штатива головку термометра и плотно зажав основной стержень термометра посередине левой рукой, быстро вынимают его из воды и, энергично стукнув руку с зажатым термометром о другую, вызывают отрыв верхней ртути от капилляра. Слегка подогрев рукой нижний резервуар со ртутью, вызывают расширение ртути, что тотчас замечают по небольшой капельке ртути, которая появится у конца капилляра в верхнем резервуаре. Эту капельку следует стряхнуть в верхний резервуар. Необходимо проверить – достаточно ли этого количества сброшенной ртути – повторным погружением термометра в стакан с водой. Если температура, соответствующая температуре замерзания растворителя, попадает на шкалу выше желаемого деления (наиболее удобным для опыта является положение ртути между вторым и четвёртым делениями шкалы), то стряхивание капельки ртути следует повторить и ещё раз проверить показание термометра, опустив его в тот же стакан с водой. С настроенным термометром Бекмана следует обращаться особенно осторожно: его нельзя класть на стол или оставлять длительное время при комнатной температуре. В нерабочие промежутки времени термометр должен быть укреплен вертикально за головку в штативе, а его нижний резервуар со ртутью – опущен непосредственно в жидкость, погруженную в охладительную смесь.
|
|
|
Последовательность выполнения работы
1. В пробирку наливают 40 см3 исследуемого растворителя и помещают её в рабочий стакан микрохолодильника.
2. В микрохолодильник пускают проточную воду.
3. Включают выпрямитель ВСП-33 в сеть на 220 В.
4. Устанавливают переключатель трансформатора в положение 1 (рис. 3.4).
5. Для постепенного усиления охлаждения через 20 мин устанавливают переключатель трансформатора в положение 2, а ещё через 20 мин – в положение 3 (рис. 3.4).
6. После замерзания растворителя переключатель трансформатора переводят в положение 1, при котором следует выполнять работу.
7. Настраивают термометр Бекмана в отдельной охладительной смеси со льдом, как это описано выше. Настраивать термометр нужно так, чтобы положение столбика ртути было между значениями 2 и 4 шкалы.
8. Быстро ополаскивают термометр чистым растворителем, вытирают его и переносят в рабочую пробирку с охлаждённым исследуемым растворителем.
9. Определяют температуру замерзания чистого растворителя. Для этого устанавливают пробирку с чистым растворителем и погруженным в него термометром в рабочий стакан холодильника.
10. Определяют температуру замерзания раствора. Для этого в пробирку с чистым растворителем помещают навеску исследуемого вещества, размешивают до полного растворения и повторяют измерения температуры замерзания.
11. Полученные результаты заносят в табл. 3.2.
Таблица 3.2
| Исследуемая система | Температура кристаллизации | DТзам, град | Молярная масса | |
| опытная | истинная | |||
| Чистый растворитель Раствор |
Контрольные вопросы
1. Напишите выражение закона Рауля и проиллюстрируйте его на графике давление пара – температура.
2. С помощью графика объясните следствия из закона Рауля.
3. Какие свойства называют коллигативными свойствами разбавленных растворов?
4. Укажите связь между понижением температуры замерзания и концентрацией раствора. Чем определяется коэффициент пропорциональности?
Работа 3.3.Расчёт термодинамических характеристик растворов
Цель работы. Вычислить парциальные мольные величины компонентов раствора методом касательной или методом пересечений.
Методика выполнения работы. Известны два основных метода определения парциальных мольных величин. Первый метод – метод касательной – заключается в построении касательной к графику зависимости общего экстенсивного свойства раствора от количества одного из компонентов при постоянстве температуры, давления и количества другого компонента (рис. 3.5). Парциальной мольной величине свойства компонента соответствует тангенс угла наклона касательной, вычисленный по отношению длин катетов треугольника в единицах размерности осей координат.
Второй метод определения парциальных мольных величин – метод пересечений (или метод отрезков) – используется для бинарных растворов. Метод заключается в построении графика зависимости экстенсивного свойства раствора, отнесённого к 1 молю раствора, от мольной доли одного из компонентов и в проведении касательной к кривой при заданной концентрации до пересечения с вертикальными осями координат при Хi = 0 и Хi = 1. Отрезки, отсекаемые касательной на этих осях, соответствуют  парциальным мольным свойствам компонентов (рис. 3.6).
парциальным мольным свойствам компонентов (рис. 3.6).
Рис. 3.5. К определению парциальной мольной величины  компонента методом касательной
компонента методом касательной

Рис. 3.6. К определению парциальных мольных величин компонентов  и
и  бинарного раствора методом пересечений
бинарного раствора методом пересечений
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 66; Нарушение авторских прав?; Мы поможем в написании вашей работы!