
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Последовательность выполнения работы
|
|
|
|
1. Определяют константу ячейки φ специальной конструкции (рис. 4.7). С этой целью заливают в неё ~20 см3 стандартного 0,02 н раствора KCl и измеряют его сопротивление (R KCl). Зная R KCl и табличное значение удельной электрической проводимости χKCl при данной температуре, по уравнению (4.26) рассчитывают константу ячейки.

Рис. 4.7. Электрохимическая ячейка:
1 – электроды; 2 – кран; 3, 4 – резервуары; а, б – отметки
2. Определяют удельную электрическую проводимость дистиллированной воды. Для этого заливают в ячейку ~20 см3 дистиллированной воды и измеряют её сопротивление или удельную электропроводимость. Значение c дистиллированной воды должно быть в пределах 4,4·10 – 8 ÷ 1·10 – 6 Ом – 1·см – 1 (из-за растворенных в ней CO2 и NH3, содержащихся в воздухе). Для вычисления c электролита измеренную электрическую проводимость воды или рассчитанную по уравнению:

вычитают из электрической проводимости раствора:

3. Измеряют сопротивление (R) раствора электролита при различных температурах в интервале 15 – 90 °С, через каждые 10 - 12 градусов). Показания заносят в табл. 4.5.
Таблица 4.5
Электролит________ Растворитель_______ Концентрация раствора_______
| № опыта | t, ºC | Т, К | R, Ом | τ, c | χ, Ом–1·см–1 | λ, См·см2/г-экв | E λ, Дж/моль | τо, с | η, Па∙с | Е η, Дж/моль |
4. При тех же температурах определяют время истечения раствора электролита (τ, с) из резервуара 3 (от отметки а) в резервуар 4 (до отметки б) по секундомеру. (Технику заполнения ёмкости 3 раствором объясняет лаборант). Показания заносят в табл. 4.5.
5. На основании полученных данных рассчитывают:
– удельную электрическую проводимость χ раствора электролита при различных температурах по уравнениям (4.24) и (4.26);
|
|
|
– эквивалентную электрическую проводимость λ раствора электролита при различных температурах по уравнению (4.12);
– энергию активации Е λ процесса электрической проводимости по уравнению (4.17);
– вязкость раствора η при различных температурах:
 ,
,
где τо – время истечения растворителя (из графика зависимости τо – t °С, полученного у лаборанта); ηо – вязкость растворителя, мПа·с [5]; ρ, ρо – плотность раствора и растворителя, кг/м3 [5];
– энергию активации Е η процесса вязкого течения жидкости по уравнению (4.19), Дж/моль.
6. Расчетные данные заносят в табл. 4.5.
7. Строят графики зависимости 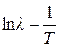 и
и  . Графически определяют из них энергии активации.
. Графически определяют из них энергии активации.
8. Делают выводы по проделанной работе.
Контрольные вопросы к лабораторным работам 4.1 – 4.5
1. Какие электролиты называют сильными, слабыми? Приведите примеры.
2. Что называют степенью электролитической диссоциации, пределы ее изменения?
3. Что называют константой электролитической диссоциации? Как она зависит от температуры?
4. Закон разбавления Оствальда. Выведите его в общем виде (для любого электролита) и для случая диссоциации уксусной кислоты.
5. Что называют скоростью движения, подвижностью, молярной электрической проводимостью ионов?
6. Дайте формулировки удельной, молярной и эквивалентной электрической проводимости, приведите формулы для их расчёта.
7. От каких факторов зависят величины c, L и l?
8. Сформулируйте закон независимого движения ионов (закон Кольрауша), обоснуйте его.
9. Уравнение Кольрауша, физический смысл констант l0 и А.
10. В чём суть электрофоретического и релаксационного эффектов торможения движения ионов?
11. Средние ионные величины, вычисление g± по уравнению Дебая–Хюккеля.
12. Как измеряют электрическое сопротивление растворов?
|
|
|
13. Какие физико-химические величины можно определить на основе электрической проводимости растворов?
14. Равновесие между твердым электролитом и насыщенным раствором, растворимость S.
15. Что называют произведением растворимости L? Методики определения L.
16. Вязкость растворов, методы её измерения, зависимость от температуры.
17. Методы определения изменения термодинамических функций (D G, D H и D S) процесса электролитической диссоциации.
4.3. Равновесные электрохимические процессы в
гальванических элементах
Одним из самых перспективных, универсальных и простых в экспериментальном исполнении методов определения различных физико-химических параметров растворов и химических реакций является потенциометрический метод. Его суть заключается в экспериментальном измерении электродвижущей силы (ЭДС), которая пропорциональна максимальной полезной работе W'max химической реакции, протекающей обратимо в гальваническом элементе.
4.3.1. Электрохимические цепи
Электрохимическая система - это система, состоящая из нескольких различных фаз, содержащих заряженные частицы: ионы и электроны. Электрохимическая система, производящая электрическую энергию за счёт происходящих в ней химических превращений, называется электрохимической цепью, гальваническим элементом или химическим источником тока.
Правильно разомкнутая электрохимическая цепь состоит из двух электродов, каждый из которых представляет собой металл (М1 и М2), опущенный в раствор (L1 и L2) собственной соли (рис.4.8).

Рис. 4.8. Схема правильно разомкнутого гальванического элемента
Условная запись этой электрохимической цепи имеет вид:
M1 | M2 | L2||L1| M1,
где вертикальная линия означает границу раздела между разными фазами, а двойная вертикальная линия – солевой мостик, соединяющий растворы L1 и L2. Из-за разности химических и электрических потенциалов частиц соприкасающихся фаз на их границах возникают скачки потенциала, которые называют:
М1 |М2 - "металл-металл" - контактный потенциал (скачок потенциала);
M | L1 - "металл-раствор" - электродный потенциал;
L1||L2 - "раствор-раствор" - диффузионный потенциал.
Если к концам такой цепи присоединить вольтметр, то обнаруживается разность потенциалов. Разность потенциалов, измеренная в том случае, когда через вольтметр (внешнюю цепь) с сопротивлением R ® ¥ протекает ток I ® 0, называют электродвижущей силой (ЭДС) гальванического элемента.
|
|
|
При движении электрических зарядов в цепи, как показано на рис. 4.8, левый электрод М2 является отрицательным полюсом электрохимической цепи, а правый электрод М1 - положительным полюсом. При этом ЭДС цепи Е > 0.
Электродный потенциал. Самыми большими из показанных на рис. 4.8 являются скачки потенциала на границе "металл - раствор". Поскольку экспериментально нельзя определить абсолютную разность (скачок) потенциалов между двумя различными фазами (M2|L; L|M1), вводится условная шкала относительных величин. Эти величины называют электродными потенциалами.
Согласно конвенции Международного союза по чистой и прикладной химии (IUPAC, 1953 г.), электродный потенциал Е - это ЭДС цепи, составленной из исследуемого электрода |L| M (справа) и стандартного водородного электрода (слева):
М | Рt÷ Н2 (Р = 1 атм) | Н+(a H+ = 1) || L| M
Тогда знак потенциала исследуемого электрода совпадает со знаком ЭДС цепи. При этом считается, что диффузионный потенциал между растворами L1 || L2 Е д » 0 практически устранён или Е д = const - диффузионный потенциал не устранён и через границу между растворами осуществляется перенос ионов.
Стандартный водородный электрод (электрод сравнения) - это водородный электрод с активностью ионов Н+ (Н3О+) в растворе, равной 1, и парциальным давлением газообразного водорода, равным 1 атм. На водородном электроде протекает реакция:
Н+ + e ®  Н2,
Н2,
и его потенциал принимается равным нулю при любой температуре.
Кроме стандартного водородного электрода, в качестве электродов сравнения могут использоваться: хлорид-серебряный, каломельный, ртутно-сульфатный и ртутно-оксидный электроды.
Измерение электродного потенциала относительно любого из этих электродов сравнения прибавит к его величине константу, т.е. приведет только к сдвигу шкалы.
Стандартный электродный потенциал Е ° - это ЭДС цепи, составленной из стандартного водородного электрода и исследуемого электрода в стандартных условиях (т.е. при активности потенциалопределяющих веществ в растворе, равной 1). Стандартные электродные потенциалы и отвечающие им электродные реакции восстановления сведены в таблицы [1].
|
|
|
Знак стандартного электродного потенциала означает, что потенциал данного электрода более положителен или более отрицателен, чем потенциал стандартного водородного электрода. Величина стандартного электродного потенциала характеризует способность компонентов электрохимической системы М1|М2|L2||L1|М1 к окислению-восстановлению в стандартных условиях.
На электроде с более положительным стандартным электродным потенциалом (катоде) протекает реакция восстановления (присоединение электронов):
М1z+ + z e- ® М1,
а на электроде с более отрицательным стандартным электродным потенциалом (аноде) протекает реакция окисления (отдача электронов):
М2 - z e- ® М2 z+,
где z+, z-- заряды ионов.
ЭДС электрохимической цепи - разность электродных потенциалов. ЭДС любой электрохимической цепи равна разности электродных потенциалов, выраженных в одной и той же шкале, т.е. относительно одного и того же электрода сравнения:
Е = Е+ - Е-
Если между растворами диффузионный потенциал не устранен, то
Е = Е+ - Е- ± Е Д
Стандартная ЭДС электрохимической цепи - это разность стандартных электродных потенциалов:

где  - постоянные величины при Р, Т = const.
- постоянные величины при Р, Т = const.
Зависимость ЭДС электрохимической цепи и электродного потенциала от активности компонентов электродных реакций. Химическую реакцию, которая сопровождается переходом электронов между частицами двух участвующих в реакции веществ, можно записать в виде:
n1Ox1 + n2Red2 = n1Red1 + n2Ox2, (4.27)
где Ox - окисленная форма; Red - восстановленная форма; n1 и n2 – стехиометрические коэффициенты. В электрохимической цепи реакция (4.27) разбивается на два электродных процесса (две полуреакции), которые разделены в пространстве:
Å Ox1 + z 1е ® Red1 – восстановление на катоде
yRed2 – z2е ® Ох2 – окисление на аноде.
При этом стехиометрические коэффициенты n1 и n2 реакции (4.27) соответствуют условию:
n1 z 1 = n2 z 2 = n,
где n - число электронов, которое должно пройти через электрохимическую цепь при однократном протекании реакции (4.27).
Потенциал каждого из электродов зависит от активностей ионов (ai), участвующих в электродной реакции и рассчитывается по уравнению Нернста:
 (4.28)
(4.28)
ЭДС цепи, определяемая как разность электродных потенциалов, также рассчитывается по уравнению Нернста:
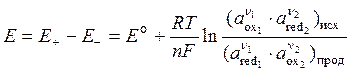 (4.29)
(4.29)
Из уравнений Нернста следует, что электродные потенциалы зависят от активностей (концентраций) потенциалопределяющих веществ (ионов). Вместе с тем электродные потенциалы зависят от активностей (концентраций) всех ионов, присутствующих в растворе и определяющих ионную силу раствора. С ионной силой раствора связан коэффициент активности потенциалопределяющего вещества, а, следовательно, и его активность.
Зависимость ЭДС электрохимической цепи от температуры. ЭДС электрохимической цепи, работающей в обратимых условиях при Р, T = const, пропорциональна максимальной полезной работе, совершаемой цепью:
W'max = – D GP,Т = n×F×E,
где F = 96485 Кл/моль - постоянная Фарадея; n - число электронов, участвующих в суммарной электрохимической реакции; D G - изменение энергии Гиббса в процессе протекания химической реакции в гальваническом элементе. С учётом уравнения Гиббса–Гельмгольца
 ,
,
где  получается уравнение, выражающее зависимость ЭДС обратимо работающей электрохимической цепи от температуры:
получается уравнение, выражающее зависимость ЭДС обратимо работающей электрохимической цепи от температуры:
 ,
,
где D H - тепловой эффект той же химической реакции, протекающей необратимо вне электрохимической цепи при P, T = const;  - температурный коэффициент ЭДС, характеризующий изменение энтропии в ходе реакции:
- температурный коэффициент ЭДС, характеризующий изменение энтропии в ходе реакции:

Тепловой эффект q той же химической реакции, протекающей обратимо в электрохимической цепи при P,T = const:

Классификация электродов
Электрод - электрохимическая система, состоящая минимум их двух фаз, на границе которых протекают окислительные или восстановительные процессы.
Обратимые электроды. Электрод включает в себя электрический проводник I рода (металл, уголь) и проводник II рода (раствор, расплав). На обратимых электродах в зависимости от условий протекают одни и те же полуреакции либо в прямом, либо в обратном направлении.
В соответствии с IUPAC для электродов принята следующая форма записи (например, для окислительно-восстановительного электрода):
Ox, Red | Pt
вещества фаза
в растворе металла
Уравнение электродной реакции
Ox + n е ® Red
Электроды I рода
1) Активный металл (М), меняющий свою степень окисления во время электродной реакции, погруженный в раствор, содержащий его ионы:
Mz+÷ M
Электродная реакция:
Мz+ + ze ® М0
Потенциал электрода (здесь и далее принято обозначать электродный потенциал E, а стандартный электродный потенциал - E°):

где z+ - заряд катиона в растворе; 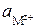 - активность катионов металла в растворе aМ - активность металла.
- активность катионов металла в растворе aМ - активность металла.
Для металлов, не содержащих примесей, aM = 1. Поэтому

Такие электроды называют обратимыми по катиону, так как их потенциал непосредственно зависит от концентрации (активности) катионов в растворе.
2) Металлоид (Me) – неметалл, погруженный в раствор, содержащий его ионы:
Mez- | Me
Электродная реакция:
Me + ze ® Mez-
Потенциал электрода:
 ,
,
где z– - заряд аниона в растворе; 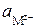 - активность аниона в растворе;
- активность аниона в растворе;  - активность металлоида. Если принять
- активность металлоида. Если принять  = 1, то
= 1, то

Такие электроды называют обратимыми по аниону, так как их потенциал непосредственно зависит от концентрации (активности) анионов в растворе.
3) Амальгама металла (раствор металла в ртути - M(Hg)), погруженная в раствор, содержащий катионы этого металла (МZ+):

Электродная реакция:
Mz+ + ze = M(Hg)
Потенциал электрода

где aMz+ - активность катионов металла в растворе, aM(Hg) ¹ 1 - активность металла в амальгаме.
Электроды II рода. Это активный металл (М), покрытый слоем его малорастворимого соединения (Мn+Аn-) (соли, оксида, гидроксида) и погруженный в раствор хорошо растворимого электролита, содержащий тот же анион (Аz-), что и малорастворимое соединение:

Электродная реакция
 + nе = n+Mo + n–Az–,
+ nе = n+Mo + n–Az–,
где n = n+z+ = n–|z–| - число электронов, z+ – заряд катиона, z– – заряд аниона.
Потенциал электрода с учетом того, что активность чистых твердых фаз am = 1 и  = 1:
= 1:

или

где  - произведение растворимости малорастворимого соединения. Потенциалы электродов II рода стабильны во времени и мало меняются с температурой. Поэтому электроды II рода чаще всего используют в качестве электродов сравнения.
- произведение растворимости малорастворимого соединения. Потенциалы электродов II рода стабильны во времени и мало меняются с температурой. Поэтому электроды II рода чаще всего используют в качестве электродов сравнения.
Газовые электроды. Это электрический проводник I рода из инертного материала (Pt, Au, Ir, С), контактирующий одновременно с газом и с раствором, содержащим ионы этого газа. Газовые электроды могут быть обратимыми относительно катиона (водородный) или относительно аниона (хлорный, кислородный). Пример: водородный электрод (нестандартный)
H+ | H2ïPt
Электродная реакция:
Н+ + е =  Н2
Н2
Потенциал электрода:
 ,
,
где 
При низких давлениях активность газа  можно заменить на его относительное парциальное давление
можно заменить на его относительное парциальное давление  :
:
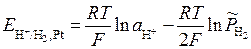
Если 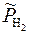 = 1 атм, то
= 1 атм, то

Водородный электрод может быть использован для измерениярН растворов в пределах от 1 до 8.
Окислительно-восстановительные электроды (редокс-электроды). Это система, состоящая из инертного электрического проводника I рода, погруженного в раствор, содержащий окисленную и восстановленную формы одного и того же химического элемента (вещества):
Oх, Red | Pt
Электродная реакция
Ox + ne ® Red
Электродный потенциал

Ионоселективные электроды - электроды, потенциал которых пропорционален концентрации определенного вида ионов. Н+, Na+, К+, Li+, Cu2+, Cd2+, Рb2+, Ag+, Ca2+, Ba2+, NH4+, Hg2+, Cl–, Br–, J–, NO3–, СO32–, F–, ClO4–, CN–, CNS– и др. Перед использованием ионообменные электроды должны быть откалиброваны.
Классификация электрохимических цепей
Электрохимическая цепь (гальванический элемент) - система, состоящая минимум из двух электродов, производящая электрическую энергию за счет происходящих в ней химических превращений. Электрохимические цепи классифицируются по двум признакам (не связанным между собой):
По источнику электрической энергии в цепи:
– физические;
– химические;
– концентрационные.
По наличию границ растворов (наличию диффузионных потенциалов):
– цепь без переноса (без жидкостной границы);
– цепь с переносом (с жидкостной границей).
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 53; Нарушение авторских прав?; Мы поможем в написании вашей работы!