
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обработка результатов
1. Записывают схему исследуемого гальванического элемента.
2. Определяют потенциалы исследуемого электрода на основании данных об ЭДС: Е = Е+ - Е-
3. Записывают уравнения электрохимических реакций, протекающих на электродах, и выражения электродных потенциалов в соответствии с уравнением Нернста.
4. Используя уравнение Нернста для исследуемого электрода, рассчитывают его стандартный потенциал Е 0. При расчетах делают допущение, что

5. Рассчитывают ионную силу раствора:
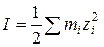 ,
,
где mi = ni× m; т – моляльная концентрация электролита с учётом разбавлений.
6. Используя уравнение Дебая–Хюккеля (предельный закон)
 ,
,
рассчитывают коэффициенты активности окисленной и восстановленной форм, а затем  .
.
7. По уравнению Нернста рассчитывают Е° и сравнивают его со значением, найденным в п. 4 и справочной величиной.
8. Записывают суммарную реакцию, протекающую в элементе.
9. По значению Е° определяют константу равновесия суммарной реакции и D G ° T.
10. Строят графики зависимости:
 и
и 
и определяют Е° графически.
Часть 2. Изучение влияния комплексообразующих веществ на
потенциал окислительно-восстановительного электрода
По характеру изменения потенциала окислительно-восстановительного электрода от количества добавленного комплексообразователя можно судить об окислительно-восстановительной способности раствора: чем положительнее потенциал электрода, тем больше окислительное действие раствора, и наоборот.
В окислительно-восстановительные системы (часть 1) добавляют раствор комплексообразующего вещества (по каплям) при непрерывном перемешивании.
Каждую новую порцию комплексообразователя следует добавлять только после стабилизации значения ЭДС. Суммарный объём раствора комплексообразователя должен быть около 5 см3. Результаты измерений и рассчитанные значения электродных потенциалов заносят в табл. 4.11.
Таблица 4.11
t =____°С
| Система с комплексообразователем | |||
| Соотношение форм ox/red | E, В | Е, В | Выводы |
| 9:1 8:2 7:3 6:4 5:5 4:6 3:7 2:8 1:9 |
Делают выводы об окислительно-восстановительной способности системы.
Работа 4.9. Определение термодинамических функций реакции, протекающей в гальваническом элементе
Цель работы. Ознакомиться с методикой составления гальванических элементов, содержащих окислительно-восстановительные электроды, изучить влияние температуры на ЭДС элемента, а также рассчитать изменения термодинамических функций в процессе протекания электрохимической реакции.
Порядок выполнения работы. В работе рекомендуется использовать те же окислительно-восстановительные электроды, что и в работе № 4.8. В растворы электродов № 4, 5, 6 добавляют по 8–10 капель концентрированнойсерной кислоты, так как их потенциал сильно зависит от рН среды.
Солевой мост заполняют насыщенным раствором хлорида калия и плотно закрывают с обоих концов пробками из фильтровальной бумаги. По заданию преподавателя готовят в электродных пространствах ячейки две окислительно-восстановительные системы (ячейка подсоединена к термостату). Соединяют электродные пространства солевым мостом. Выдерживают платиновые электроды 5 мин в концентрированной НNO3, промывают водопроводной, затем дистиллированной водой, сушат фильтровальной бумагой.
Определяют полярность клемм измерительного прибора по стандартному элементу Вестона. Пользуясь справочником, определяют полярность двух исследуемых окислительно-восстановительных электродов. Собирают электрическую схему (рис. 4.12), включают измерительный прибор и термостат. Через 15 мин после установления заданной температуры производят измерения ЭДС (первый опыт - при комнатной температуре). В дальнейшем измерения ЭДС следует производить через каждые 5-6°,не превышая 40 °С. Результаты измерений заносят в табл. 4.12.
Таблица 4.12
| Т, К | Е, В |  ,
В/К ,
В/К
| D S, Дж/(моль×К) | D G, кДж/моль | D Н, кДж/моль |
|
|
Дата добавления: 2017-02-01; Просмотров: 67; Нарушение авторских прав?; Мы поможем в написании вашей работы!