
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обработка результатов
1. Записывают схему исследуемого гальванического элемента.
2. Записывают уравнения электрохимических реакций, протекающих на электродах, и выражения электродных потенциалов в соответствии с уравнением Нернста.
3. Записывают суммарную реакцию, протекающую в элементе.
4. Записывают уравнение Нернста для расчёта ЭДС элемента.
5. Строят график зависимости Е = f(T). Графически определяют величину и знак температурного коэффициента ЭДС. Делают вывод о влиянии температуры на ЭДС исследуемого элемента.
6. Рассчитывают изменения термодинамических функций (D S, D G, D Н) в процессе протекания электрохимической реакции.
7. Используя справочные данные (значения стандартных электродных потенциалов, теплот образования, абсолютных энтропий), рассчитывают D S °, D G °, D Н ° данной реакции. Сравнивают с экспериментально полученными значениями и объясняют причины расхождения результатов.
Контрольные вопросы к лабораторным работам 6 – 9
1.Какое устройство называют электрохимической цепью?
2.Опишите устройство электрохимической цепи с жидкостным соединением и без него.
3.Чем отличается реакция в электрохимической цепи от той же реакции, осуществляемой в обыкновенном сосуде?
4.Дайте определение ЭДС электрохимической цепи.
5.Дайте определение стандартному электродному потенциалу.
6.Как рассчитывают ЭДС на основе электродных потенциалов?
7.Напишите уравнение Нернста для зависимости ЭДС электрохимической цепи от активностей участников протекающей в ней реакции.
8.Каковы правила записи реакций, протекающих на отдельных электродах?
9.Напишите уравнение Нернста для потенциала электрода первого рода. От чего зависит значение и знак потенциала такого электрода?
10. Какие электрохимические цепи называют химическими? Приведите пример, напишите схему.
11. Какие электрохимические цепи называют концентрационными? Приведите пример, напишите схему.
12. Какие электроды можно применять в качестве индикаторных при измерении рН водных растворов?
13. По данным о стандартных потенциалах установите, осуществима ли при 298 К в водном растворе реакция Ag+ + Fe2+ = Ag + Fe3+. Рассчитайте константу равновесия этой реакции. (Ответ: 0,336)
14. Рассчитайте рН раствора НС1, если ЭДС электрохимической цепи, состоящей из водородного электрода (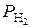 = 1 атм) в исследуемом растворе и каломельного электрода (Е кал = 0,3341 В), при 298 К равна 0,5 В. (Ответ: 2,8).
= 1 атм) в исследуемом растворе и каломельного электрода (Е кал = 0,3341 В), при 298 К равна 0,5 В. (Ответ: 2,8).
Глава 5. Химическая кинетика и катализ
5.1. Основные понятия химической кинетики
Химическая кинетика – наука о скоростях и механизмах химических превращений, о явлениях, сопровождающих эти превращения, и о факторах, влияющих на них.
Химическая кинетика устанавливает связь между скоростью химической реакции и условиями её проведения. Тем самым она определяет реальность осуществления различных химических процессов, принципиальная возможность которых установлена термодинамически. Химическая кинетика стремится раскрыть механизм реакции, т.е. выяснить, из каких элементарных стадий она состоит, как эти стадии связаны между собой, какие промежуточные продукты принимают участие в химическом процессе.
Элементарная стадия (элементарный химический акт) – превращение одной или нескольких находящихся в контакте частиц (молекул, радикалов, ионов) в другие частицы за время порядка 10–13 с.
Механизм химической реакции – совокупность элементарных стадий, из которых складывается процесс превращения исходных веществ (реагентов) в конечные вещества (продукты).
Простая реакция – это одностадийный, односторонний химический процесс, в котором осуществляются одни и те же элементарные акты взаимодействия между молекулами с преодолением одного энергетического барьера.
Промежуточные частицы – частицы, образующиеся в одних стадиях химического процесса и расходующиеся в других стадиях. Промежуточными частицами могут быть устойчивые молекулы (стабильные промежуточные вещества), неустойчивые молекулы и ионы, свободные радикалы, ион-радикалы (лабильные промежуточные вещества).
В зависимости от фазового состояния исходных веществ и продуктов реакции различают реакции:
– гомогенные – протекающие в пределах одной фазы: в смеси газов, в жидком растворе или в твёрдой фазе;
– гетерогенные – протекающие на границе раздела фаз: двух твёрдых, твёрдой и жидкой, твёрдой и газообразной, двух жидких, жидкой и газообразной;
– гомогенно-гетерогенные – сложные химические реакции, в которых одни стадии являются гомогенными, а другие гетерогенными;
– гомофазные – реакции, в которых исходные вещества, промежуточные вещества и продукты реакции находятся в одной фазе;
– гетерофазные – реакции, в которых исходные вещества, промежуточные вещества и продукты реакции образуют более чем одну фазу.
Молекулярность реакции – число частиц, принимающих участие в элементарном акте химического взаимодействия.
Кинетическая кривая – график зависимости концентрации реагента или продукта от времени.
Кинетическое уравнение – математическое выражение, описывающее изменение концентрации компонента реакции во времени.
Стехиометрическое уравнение реакции может быть представлено в виде:
а 1А1 + а 2А2 + а 3А3 +… = b 1B1 + b 2B2 + b 3B3 +…, (5.1)
где A1, A2, A3,... – исходные вещества (реагенты), B1, B2, B3, … – конечные вещества (продукты), a 1, a 2, a 3, … – стехиометрические коэффициенты для исходных веществ, b 1, b 2, b 3, … – стехиометрические коэффициенты для продуктов реакции.
Скорость химической реакции по компоненту (vi) равна количеству данного компонента, прореагировавшего в единицу времени в единице объёма:
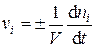 , (5.2)
, (5.2)
где n i – число молей (или молекул) компонента i в объёме V.
Для реагентов производная 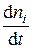 отрицательна, в то время как скорость реакции всегда положительна, поэтому в уравнении (5.2) появляется знак «–». Если скорость реакции определяют по продукту реакции, то уравнение (5.2) используют со знаком плюс.
отрицательна, в то время как скорость реакции всегда положительна, поэтому в уравнении (5.2) появляется знак «–». Если скорость реакции определяют по продукту реакции, то уравнение (5.2) используют со знаком плюс.
Если объём системы не изменяется, его можно ввести в уравнение (5.2) под знак дифференциала. Отношение 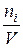 – молярная концентрация компонента i (c i). Таким образом, скорость гомогенной химической реакции, протекающей в закрытой системе при постоянном объеме, по данному компоненту может быть определена как производная от концентрации этого компонента по времени:
– молярная концентрация компонента i (c i). Таким образом, скорость гомогенной химической реакции, протекающей в закрытой системе при постоянном объеме, по данному компоненту может быть определена как производная от концентрации этого компонента по времени:
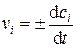 (5.3)
(5.3)
Если в закрытой системе при постоянном объёме протекает гомогенная химическая реакция, описываемая одним стехиометрическим уравнением, то для однозначного определения её скорости достаточно следить за изменением концентрации какого-либо одного компонента. Изменения концентраций других участников реакции можно найти по соотношениям стехиометрических коэффициентов:
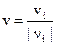 (5.4)
(5.4)
Так, скорость реакции (5.1) выражается соотношением
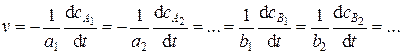 (5.5)
(5.5)
Для определения скорости химической реакции по какому-либо компоненту необходимо определить концентрацию этого компонента в различные моменты времени, т.е. установить зависимость 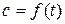 для этого компонента. Скорость реакции по этому компоненту определяется в соответствии с уравнением (5.3) дифференцированием найденной зависимости.
для этого компонента. Скорость реакции по этому компоненту определяется в соответствии с уравнением (5.3) дифференцированием найденной зависимости.
Если зависимость 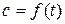 изображена графически, то истинная скорость реакции по определенному компоненту равна тангенсу угла наклона касательной к его кинетической кривой в точке, отвечающей выбранному моменту времени.
изображена графически, то истинная скорость реакции по определенному компоненту равна тангенсу угла наклона касательной к его кинетической кривой в точке, отвечающей выбранному моменту времени.
Простейший вид кинетических кривых для реагента (А i), концентрация которого убывает во времени, и продукта реакции (B i), концентрация которого растёт во времени до некоторого предельного значения, представлен на рис. 5.1.
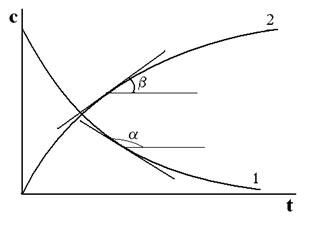
Рис. 5.1. Зависимость концентрации исходного вещества (1) и продукта реакции (2) от времени
Определив скорость реакции по какому-либо компоненту, по соотношению (5.5) вычисляют скорость реакции в целом.
Размерность скорости химической реакции определяется по формуле:
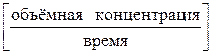 .
.
Скорость химической реакции является функцией концентраций компонентов реакционной смеси, а математическое соотношение, выражающее зависимость скорости реакции от концентрации реагентов, называют кинетическим уравнением химической реакции.
В общем случае кинетическое уравнение может иметь довольно сложный вид. Часто скорость выражается степенной функцией концентраций реагентов. Так, для реакции (5.1) кинетическое уравнение записывают в виде
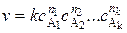 , (5.6)
, (5.6)
где v – скорость реакции; k – константа скорости реакции (удельная скорость); 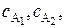 …,
…, 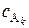 – концентрации реагентов; n 1, n 2, …, nk – частные порядки реакции: n 1 – по компоненту A1, n 2 – по компоненту А2, nk – по компоненту Ak.
– концентрации реагентов; n 1, n 2, …, nk – частные порядки реакции: n 1 – по компоненту A1, n 2 – по компоненту А2, nk – по компоненту Ak.
Соотношение (5.6) называют основным постулатом химической кинетики. Для простых реакций, протекающих в одну стадию, скорость, пропорциональна произведению концентраций реагирующих веществ, возведённых в степени, соответствующие стехиометрическим коэффициентам.
Порядок реакции по данному реагенту (частный порядок) равен показателю степени, в которой концентрация реагента входит в кинетическое уравнение скорости реакции. Общий порядок равен сумме показателей степеней концентраций всех реагентов, которые входят в кинетическое уравнение скорости реакции.
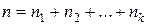 ,
,
где n – полный (общий, суммарный) порядок реакции.
Порядок простых реакций совпадает с молекулярностью и равен числу частиц, участвующих в элементарном акте. Он всегда положителен и целочислен (n = 1, 2, 3). Порядок сложной реакции может быть целочисленным, дробным, нулевым, отрицательным и переменным.
Константа скорости численно равна скорости химической реакции, если концентрации исходных веществ (или их произведение) равны единице.
Размерность константы скорости зависит от порядка реакции n и определяется по формуле:
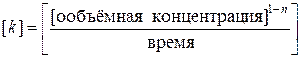
5.2. Кинетика простых реакций
Получим уравнения для зависимости концентрации исходного вещества от времени для простых и формально простых реакций первого второго, третьего и нулевого порядков: гомогенных, односторонних, протекающих в закрытых системах при постоянной температуре.
5.2.1. Реакции первого порядка
Для элементарной реакции первого порядка
А → В
дифференциальная форма кинетического уравнения имеет вид
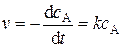 (5.7)
(5.7)
После интегрирования уравнения (5.7) в пределах от 0 до t и от 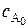 до сА получаем интегральную форму кинетического уравнения, которая записывается следующим образом
до сА получаем интегральную форму кинетического уравнения, которая записывается следующим образом
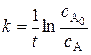 , (5.8)
, (5.8)
Или в экспоненциальной форме:
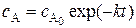 (5.9)
(5.9)
Графическая зависимость 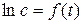 , представлена на рис. 5.2. Тангенс угла наклона прямой к оси х в этих координатах равен «– k», а отрезок, отсекаемый прямой на оси у – логарифм начальной концентрации.
, представлена на рис. 5.2. Тангенс угла наклона прямой к оси х в этих координатах равен «– k», а отрезок, отсекаемый прямой на оси у – логарифм начальной концентрации.
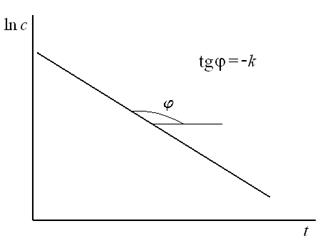
Рис. 5.2. Зависимость ln с от времени для реакции первого порядка
Размерность константы скорости реакции первого порядка [время]-1.
Время полупревращения (или полураспада) – это промежуток времени, в течение которого реагирует половина исходного количества вещества, т.е. 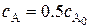 . С учётом этого из уравнения (5.8) получаем:
. С учётом этого из уравнения (5.8) получаем:
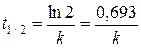 (5.10)
(5.10)
Таким образом, для реакции первого порядка время полупревращения не зависит от начальной концентрации реагентов и определяется только константой скорости реакции.
Время, за которое прореагирует 1/р (р = 3, 4, 5…) исходного вещества может быть найдена из уравнения:
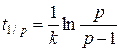 (5.11)
(5.11)
Обратная величина константы скорости мономолекулярной реакции первого порядка имеет физический смысл средней продолжительности жизни отдельной молекулы 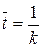
5.2.2. Реакции второго порядка
Рассмотрим реакцию второго порядка
А + В → продукты
Случай 1. Начальные концентрации реагентов одинаковы, т.е. 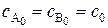
Дифференциальная форма кинетического уравнения:
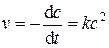 (5.12)
(5.12)
Интегральная форма кинетического уравнения:
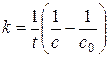 (5.13)
(5.13)
или
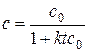 , (5.14)
, (5.14)
где с 0 – начальная концентрация реагентов А и В; с – концентрация реагентов А и В в момент времени t. Графическая зависимость 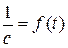 для рассматриваемого типа реакции представлена на рис. 5.3.
для рассматриваемого типа реакции представлена на рис. 5.3.
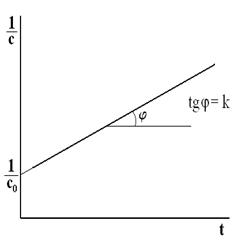
Рис. 5.3. Зависимость 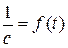 для реакции второго порядка
для реакции второго порядка
Тангенс угла наклона в этом случае равен константе скорости реакции, а отрезок, отсекаемый на оси у – величине 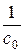 . Размерность константы скорости реакции второго порядка:
. Размерность константы скорости реакции второго порядка:
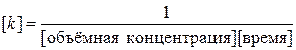
Время полупревращения получим из (5.13) при с = 0.5 с 0:
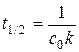 , (5.15)
, (5.15)
а время превращения на 1/р часть:
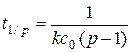 (5.16)
(5.16)
Как видно из уравнения (5.15), для реакции второго порядка время полупревращения является функцией начальной концентрации реагирующих веществ.
Случай 2. Начальные концентрации реагентов не одинаковы, т.е. 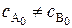 . Дифференциальная форма кинетического уравнения:
. Дифференциальная форма кинетического уравнения:
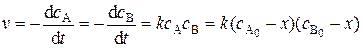 (5.17)
(5.17)
Интегральная форма кинетического уравнения:
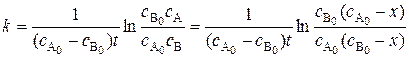 , (5.18)
, (5.18)
где 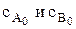 – начальные концентрации реагентов А и В, соответственно; с А и с В – концентрации реагентов А и В в момент времени t, соответственно; х – уменьшение концентраций реагентов А и В к моменту времени t.
– начальные концентрации реагентов А и В, соответственно; с А и с В – концентрации реагентов А и В в момент времени t, соответственно; х – уменьшение концентраций реагентов А и В к моменту времени t.
Время полупревращения реагента А:
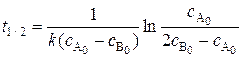 (5.19)
(5.19)
Время полупревращения реагента В:
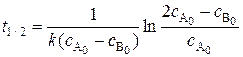 (5.20)
(5.20)
В случае если один из реагентов берётся в большом избытке, то изменением его концентрации в процессе реакции можно пренебречь:
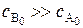 ;
; 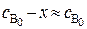
Скорость реакции при этом описывается кинетическим уравнением реакции первого порядка. В дифференциальной форме:
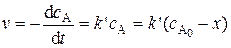 , (5.21)
, (5.21)
где 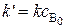 . Такие реакции называют реакциями псевдопервого порядка.
. Такие реакции называют реакциями псевдопервого порядка.
5.2.3. Реакции нулевого порядка
Дифференциальная форма кинетического уравнения:
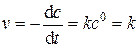 (5.22)
(5.22)
Из уравнения (5.22) следует, что скорость реакции нулевого порядка постоянна в каждый момент времени и равна константе скорости реакции.
После интегрирования от 0 до t и от с 0 до с получим:
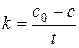
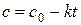
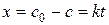 ,
,
где с 0 – начальная концентрация реагента; с – концентрация реагента в момент времени t; x – уменьшение концентрации реагента к моменту времени t. Размерность константы скорости реакции нулевого порядка:
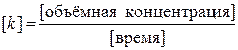
Время полупревращения:
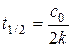
Время превращения на 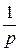 часть:
часть:
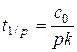
 Кинетическая кривая
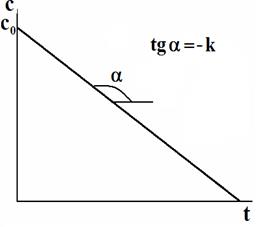
Кинетическая кривая 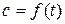 для реакции нулевого порядка является прямой линией (рис. 5.4)
для реакции нулевого порядка является прямой линией (рис. 5.4)
Рис.5.4. Зависимость концентрации от времени для реакции нулевого порядка
5.2.5. Реакции n -го порядка (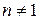 )
)
Дифференциальная форма уравнения скорости реакции n -го (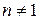 ) порядка при одинаковых концентрациях всех реагентов:
) порядка при одинаковых концентрациях всех реагентов:
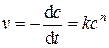 (5.23)
(5.23)
Интегральная форма кинетического уравнения:
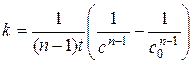 (5.24)
(5.24)
Время полупревращения получим из уравнения (5.24) при с = 0.5 с 0:
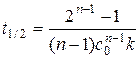 , (5.25)
, (5.25)
а время превращения на 1/ р часть:
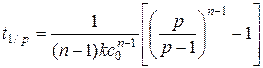 , (5.26)
, (5.26)
где c 0 – начальная концентрация реагента, с – концентрация реагента в момент времени t.
5.2.6. Методы определения порядка реакции
При определении порядка реакции используют один из следующих приёмов:
1. Приготовление стехиометрической смеси реагентов (для определения общего порядка реакции).
Для реакции:
а 1А1 + а 2А2+ а 3А3… → продукты (5.27)
все реагенты берутся в стехиометрическом соотношении. В таком случае: 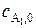 – исходная концентрация реагента A1;
– исходная концентрация реагента A1; 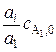 – исходная концентрация i -го реагента;
– исходная концентрация i -го реагента; 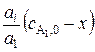 – концентрация любого реагента к моменту времени t; х – убыль концентрации А1 к моменту времени t.
– концентрация любого реагента к моменту времени t; х – убыль концентрации А1 к моменту времени t.
Уравнение скорости реакции в дифференциальной форме записывается следующим образом:
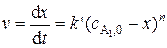 , (5.28)
, (5.28)
где 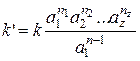 ; n – общий порядок реакции.
; n – общий порядок реакции.
2. Метод избытка (изоляции)
Для реакции (5.27) все вещества, кроме одного (например A1) берут в концентрациях настолько больших, что изменением их со временем можно пренебречь, т.е. эти концентрации можно ввести в константу скорости. Этот приём позволяет понижать порядок реакции и тем самым упрощать вид кинетических уравнений. Так, кинетическое уравнение
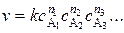
упрощается до
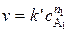 ,
,
где n – порядок реакции по веществу A1, 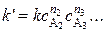
Таким же образом определяют частные порядки по каждому реагенту. Общий порядок реакции определяют как сумму частных порядков.
Все методы определения частных и общего порядков реакции можно разделить на дифференциальные и интегральные.
|
|
Дата добавления: 2017-02-01; Просмотров: 277; Нарушение авторских прав?; Мы поможем в написании вашей работы!