
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 2. Расчет тепловых эффектов химических реакций при различных температурах
|
|
|
|
Задача №6
Вычислите среднюю теплоемкость  вещества, приведенного в табл. 6, в интервале температур от 298 до Т К.
вещества, приведенного в табл. 6, в интервале температур от 298 до Т К.
Таблица 6
| Вари-ант | Вещество | Т, К | Вари-ант | Вещество | Т, К |
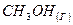
| 
| ||||

| 
| ||||

| 
| ||||
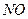
| 
| ||||
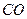
| 
| ||||

| 
| ||||

| 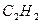
| ||||
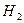
| 
| ||||
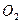
| 
| ||||
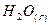
| 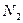
| ||||
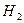
| 
| ||||
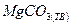
| 
| ||||
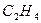
| 
| ||||
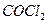
| 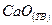
| ||||

| 
|
Решение:
Рассмотрим расчет средней теплоемкости аммиака в интервале температур от 298 до 800К.
Теплоемкость – это отношение количества теплоты, поглощаемой телом при нагревании, к повышению температуры, которым сопровождается нагревание. Для индивидуального вещества различают удельную (одного килограмма) и мольную (одного моля) теплоемкости.
Истинная теплоемкость
 , (21)
, (21)
где δQ – бесконечно малое количество теплоты, необходимое для повышения температуры тела на бесконечно малую величину dT.
Средняя теплоемкость – это отношение количества теплоты Q к повышению температуры ∆T = T2 – T1,
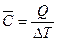 .
.
Поскольку теплота не является функцией состояния и зависит от пути процесса, необходимо указывать условия протекания процесса нагревания. В изохорном и изобарном процессах для бесконечно малого изменения δQV = dU и δQp = dH, поэтому
 и
и 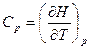 . (22)
. (22)
Связь между истинными изохорной (СV) и изобарной (Cp) теплоемкостями вещества и его средними изохорной  и изобарной
и изобарной  теплоемкостями в интервале температур от Т1 до Т2 выражается уравнениями (23) и (24):
теплоемкостями в интервале температур от Т1 до Т2 выражается уравнениями (23) и (24):
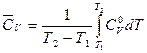 ; (23)
; (23)
 . (24)
. (24)
Зависимости истинной теплоемкости от температуры выражаются следующими эмпирическими уравнениями:
|
|
|
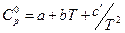 ; (для неорганических веществ) (25)
; (для неорганических веществ) (25)
 . (для органических веществ) (26)
. (для органических веществ) (26)
Воспользуемся справочником физико-химических величин. Выпишем коэффициенты (a, b, c) уравнения зависимости изобарной теплоемкости аммиака от температуры:
Таблица 7
| Вещество | 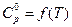
| ||
| a | b·103 | c/·10–5 | |
| NH3(Г) | 29,8 | 25,48 | –1,67 |
Запишем уравнение зависимости истинной теплоемкости аммиака от температуры:
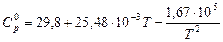 .
.
Подставим это уравнение в формулу (24) и вычислим среднюю теплоемкость аммиака:
 = 1/(800-298)
= 1/(800-298)  =
=
= 0,002 [29,8(800–298) + 25,5·10–3/2 (8002 – 2982) +
+ 1,67·105 (1/800 – 1/298)] = 43,5 Дж/моль·К.
Задача №7
Для химической реакции, приведенной в табл. 2, постройте графики зависимостей суммы теплоемкостей продуктов реакции от температуры  и суммы теплоемкостей исходных веществ от температуры
и суммы теплоемкостей исходных веществ от температуры 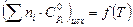 . Уравнения зависимости
. Уравнения зависимости  возьмите из справочника. Рассчитайте изменение теплоемкости в ходе химической реакции (
возьмите из справочника. Рассчитайте изменение теплоемкости в ходе химической реакции (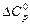 ) при температурах 298 К, 400 К и Т К (табл. 6).
) при температурах 298 К, 400 К и Т К (табл. 6).
Решение:
Рассчитаем изменение теплоемкости при температурах 298 К, 400 К и 600 К на примере реакции синтеза аммиака:
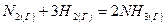 .
.
Выпишем коэффициенты (a, b, c, с/)[1] уравнений зависимости истинной теплоемкости аммиака от температуры для исходных веществ и продуктов реакции с учетом стехиометрических коэффициентов  . Вычислим сумму коэффициентов. Например, сумма коэффициентов а для исходных веществ равна
. Вычислим сумму коэффициентов. Например, сумма коэффициентов а для исходных веществ равна
 = 27,88 + 3·27,28 = 109,72.
= 27,88 + 3·27,28 = 109,72.
Сумма коэффициентов а для продуктов реакции равна
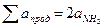 = 2·29,8 = 59,6.
= 2·29,8 = 59,6.
 =
= 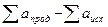 =59,6 – 109,72 = –50,12.
=59,6 – 109,72 = –50,12.
Таблица 8
| Вещество | а | b·103 | c/·10 – 5 | с·106 | |
| исходные вещества | N2 | 27,88 | 4,27 | - | - |
| H2 | 27,28 | 3,26 | 0,50 | - | |
(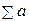 , ,  , ,  ) ) 
| 109,72 | 14,05 | 1,50 | - | |
| продукт | NH3 | 29,80 | 25,48 | –1,67 | - |
(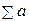 , ,  , ,  ) ) 
| 59,60 | 50,96 | –3,34 | - | |
 , ,  , , 
| –50,12 | 36,91 | –4,84 | - |
Таким образом, уравнение зависимости 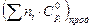
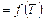 для продуктов реакции имеет следующий вид:
для продуктов реакции имеет следующий вид:
 = 59,60 + 50,96·10–3Т – 3,34·105/Т2.
= 59,60 + 50,96·10–3Т – 3,34·105/Т2.
Для построения графика зависимости суммы теплоемкости продуктов реакции от температуры  рассчитаем сумму теплоемкостей при нескольких температурах:
рассчитаем сумму теплоемкостей при нескольких температурах:
|
|
|
При Т = 298 К
 = 59,60 + 50,96·10–3 · 298 – 3,34·105/2982 = 71,03 Дж/К;
= 59,60 + 50,96·10–3 · 298 – 3,34·105/2982 = 71,03 Дж/К;
При Т= 400 К 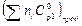 = 77,89 Дж/К;
= 77,89 Дж/К;
При Т = 600 К 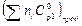 = 89,25 Дж/К.
= 89,25 Дж/К.
Уравнение зависимости 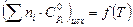 для исходных веществ имеет вид:
для исходных веществ имеет вид:
 = 109,72 + 14,05·10–3Т + 1,50·10-5/Т2.
= 109,72 + 14,05·10–3Т + 1,50·10-5/Т2.
Аналогично рассчитываем  исходных веществ при нескольких температурах:
исходных веществ при нескольких температурах:
При Т=298 К
 =109,72 + 14,05·10–3 · 298 + 1,50·105 /2982=115,60 Дж/К;
=109,72 + 14,05·10–3 · 298 + 1,50·105 /2982=115,60 Дж/К;
При Т = 400 К  = 116,28 Дж/К;
= 116,28 Дж/К;
При Т = 600 К  = 118,57 Дж/К.
= 118,57 Дж/К.
Далее рассчитываем изменение изобарной теплоемкости  в ходе реакции при нескольких температурах:
в ходе реакции при нескольких температурах:
 = –50,12 + 36,91·10–3Т – 4,84·105/Т2,
= –50,12 + 36,91·10–3Т – 4,84·105/Т2,
 = –44,57 Дж/К;
= –44,57 Дж/К;
 = –38,39 Дж/К;
= –38,39 Дж/К;
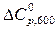 = –29,32 Дж/К.
= –29,32 Дж/К.
По рассчитанным значениям строим графики зависимостей суммы теплоемкостей продуктов реакции и суммы теплоемкостей исходных веществ от температуры.
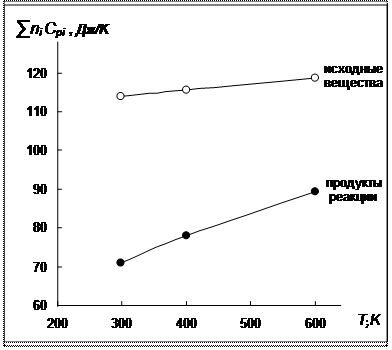
Рис 2. Зависимости суммарных теплоемкостей исходных веществ и продуктов реакции от температуры для реакции синтеза аммиака
В данном интервале температур суммарная теплоемкость исходных веществ выше суммарной теплоемкости продуктов, следовательно, 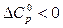 во всем интервале температур от 298 К до 600 К.
во всем интервале температур от 298 К до 600 К.
Задача №8
Вычислите тепловой эффект реакции, приведенной в табл. 2, при температуре Т К (табл. 6).
Решение:
Вычислим тепловой эффект реакции синтеза аммиака 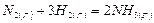 при температуре 800К.
при температуре 800К.
Зависимость теплового эффекта 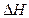 реакции от температуры описывает закон Кирхгоффа
реакции от температуры описывает закон Кирхгоффа
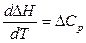 , (27)
, (27)
где  - изменение теплоемкости системы в ходе реакции. Проанализируем уравнение:
- изменение теплоемкости системы в ходе реакции. Проанализируем уравнение:
1) Если  > 0, т.е сумма теплоемкостей продуктов реакции больше суммы теплоемкостей исходных веществ, то
> 0, т.е сумма теплоемкостей продуктов реакции больше суммы теплоемкостей исходных веществ, то 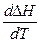 > 0,. зависимость
> 0,. зависимость  возрастающая, и с повышением температуры тепловой эффект увеличивается.
возрастающая, и с повышением температуры тепловой эффект увеличивается.
2) Если  < 0, то
< 0, то 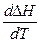 < 0, т.е. зависимость убывающая, и с повышением температуры тепловой эффект уменьшается.
< 0, т.е. зависимость убывающая, и с повышением температуры тепловой эффект уменьшается.
3) Если  = 0, то
= 0, то 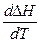 = 0, тепловой эффект не зависит от температуры.
= 0, тепловой эффект не зависит от температуры.
В интегральном виде уравнение Кирхгоффа имеет следующий вид:
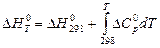 . (28)
. (28)
а) если теплоемкость во время процесса не меняется, т.е. сумма теплоемкостей продуктов реакции равна сумме теплоемкостей исходных веществ ( ), то тепловой эффект не зависит от температуры
), то тепловой эффект не зависит от температуры
|
|
|
 = const.
= const.
б) для приближенного расчета можно пренебречь зависимостью теплоемкостей от температуры и воспользоваться значениями средних теплоемкостей участников реакции ( ). В этом случае расчет производится по формуле
). В этом случае расчет производится по формуле
 . (29)
. (29)
в) для точного расчета необходимы данные по зависимости теплоемкости всех участников реакции от температуры  . В этом случае тепловой эффект рассчитывают по формуле
. В этом случае тепловой эффект рассчитывают по формуле
 (30)
(30)
Выписываем справочные данные (табл.9) и вычисляем изменения соответствующих величин для каждого столбца по аналогии с задачей №7). Полученные данные используем для расчета:
Приближенно:
 = –91880 + (–31,88)(800 – 298) = –107883,8 Дж = – 107, 88 кДж.
= –91880 + (–31,88)(800 – 298) = –107883,8 Дж = – 107, 88 кДж.
Точно:
 = –91880 + (–50,12)(800 – 298) + 1/2·36,91·10—3(8002 – 2982) +
= –91880 + (–50,12)(800 – 298) + 1/2·36,91·10—3(8002 – 2982) +
– (–4,84·105)(1/800 – 1/298) = – 107815 Дж = – 107,82 кДж.
Для реакции синтеза аммиака изменение теплоемкости в ходе реакции  < 0 (см. задачу №7). Следовательно
< 0 (см. задачу №7). Следовательно 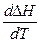 < 0, с повышением температуры тепловой эффект уменьшается.
< 0, с повышением температуры тепловой эффект уменьшается.
Таблица 9
| Вещество | Сумма для продуктов реакции | Сумма для исходных веществ | Изменение в ходе реакции | |||
| N2 | H2 | NH3 | ||||
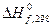 ,
кДж/моль ,
кДж/моль
| –45,94 | 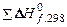  =
= –91,88 =
= –91,88
|   =
= 0 =
= 0
| 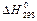 =
= –91,88 =
= –91,88
| ||
 , Дж/(моль·К) , Дж/(моль·К)
| 30,22 | 29,28 | 43,09 |  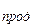 =
= 86,18 =
= 86,18
|   =
= 118,06 =
= 118,06
|  =
= –31,88 =
= –31,88
|
| a | 27,88 | 27,28 | 29,80 | 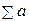 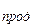 =
= 59,60 =
= 59,60
| 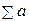  =
= 109,72 =
= 109,72
|  =
= –50,12 =
= –50,12
|

| 4,27 | 3,26 | 25,48 |  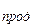 =
= 50,96 =
= 50,96
|   =
= 14,05 =
= 14,05
|  =
= 36,91 =
= 36,91
|

| - | 0,50 | –1,67 |  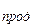 =
= –3,34 =
= –3,34
|   = 1,5 = 1,5
|  =
= –4,84 =
= –4,84
|

| - | - | - | 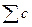 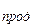 = 0 = 0
| 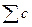  = 0 = 0
| 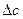 = 0 = 0
|
[1] Для органических веществ уравнение зависимости теплоемкости от температуры Ср = а + bT + cT2, для неорганических Ср = а + bT + c//T2.
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 116; Нарушение авторских прав?; Мы поможем в написании вашей работы!