
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Анализ нестойких лекарственных форм.
|
|
|
|
Лабораторная работа №2. Раствор аммиака 10%
Цель работы: Оценка качества анализируемой лекарственной формы.
Подлинность:
NH3 + HCl → NH4Cl
При поднесении к препарату стеклянной палочки, смоченной соляной кислотой, образуется белый дым.
Количественное определение: Аммиак определяют ацидиметрическим методом.
Методика определения
В мерную колбу емкостью 50мл наливают 10-15мл воды, 5мл препарата, доводят объем раствора водой до метки и перемешивают. К 2мл полученного разведения прибавляют 1 каплю метилового оранжевого и титруют 0.1000н раствором соляной кислоты до слабо-розовой окраски.
1мл 0.1000н раствора соляной кислоты соответствует 0.001703г аммиака.
Расчет содержания аммиака проводят по формуле:
ωNH3 = 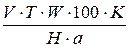 ,%
,%
W - объем мерной колбы, в которой производили разведение;
а - объем раствора, взятый для анализа (аликвота);
V - объем титрованного раствора, израсходованного на титрование, мл;
Т -титр по определяемому веществу - масса определяемого вещества, соответствующая 1мл титрованного рабочего раствора, г/мл;
Н - навеска или объем лекарственной формы.
К -коэффициент поправки титрованного раствора (К =1, если концентрация раствора равна 0.1000н).
Примечание: Аммиака в препарате должно быть не менее 9.5% и не более 10.5%.
Лабораторная работа №3. Раствор перекиси водорода 3%
Цель работы: Оценка качества анализируемой лекарственной формы.
Подлинность:
K2Cr2O7 + 4H2O2 + H2SO4 → 2H2CrO6 + 3H2O + K2SO4
К нескольким каплям препарата прибавляют 3-5 капель разведенной серной кислоты, 1мл эфира, 2-3 капли раствора бихромата калия и взбалтывают, эфирный слой окрашивается в синий цвет (получение надхромовой кислоты).
Количественное определение: Перекись водорода определяют перманганатометрическим методом.
|
|
|
5H2O2 + 2KMnO4 + 3H2SO4 → 2MnSO4 + K2SO4 + 8H2O + SO2
Методика определения
2.5мл препарата помещают в мерную колбу емкостью 50мл, доводят объем раствора водой до метки и перемешивают. К 5мл полученного разведения вливают 2-3 капли разведенной серной кислоты и титруют 0.1000н раствором перманганата калия до слабо-розового окрашивания, не исчезающего в течение 1мин.
1мл 0.1000н раствора перманганата калия соответствует 0.001701г перекиси водорода.
Расчет содержания перекиси водорода проводят по формуле:
Примечание: Содержание перекиси водорода в препарате должно составлять 2.7-3.3%.
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 158; Нарушение авторских прав?; Мы поможем в написании вашей работы!