
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
В комплексных соединениях 1 страница
Введение
Москва 2003
Учебное пособие
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
В.В.Теплов
Москва 2003
Учебное пособие
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
В.В.Теплов
Тема 14. Оформление полномочий Октавиана Августа.
Источники
1.Хрестоматия по истории Древнего Рима / И. Гвоздева [и др.]; под ред. В.И. Кузищина. – М.: Высш. школа, 1987. – С. 165-189.
2. Шифман, И.Ш. Цезарь Август / И.Ш. Шифман. – Л.: Наука, 1990. – 199 с.
Задача работы – изучить мероприятия Октавиана Августа, способствующие укреплению его личной власти, вскрыть сущность установленной Августом формы правления. Основным источником по теме следует признать политическое завещание императора - «Деяния божественного Августа». Следует помнить о тенденциозности этого документа, в котором Октавиан стремился оправдать свою деятельность. Скорректируйте и дополните автобиографические записи Августа сочинениями древних авторов – Диона Кассия и Светония.
Рассмотрите отличительные черты принципата как государственной системы управления. Выясните, из каких элементов состояла власть принцепса, какие республиканские формы были им использованы. Расскажите о мероприятиях Октавиана, направленных на укрепление своей личной власти. Обратите внимание на взаимоотношения Октавиана с сенатом, народным собранием и магистратами. Укажите, какие изменения произошли в составе сената и магистратур, а также в процедуре работы народного собрания и как это сказалось на закреплении монархических тенденций. Установите, в чем Август отступил от норм республиканской конституции и какое идеологическое обоснование получила его власть. Сделайте вывод относительно причин утверждения принципата на начальном этапе формирования римской империи.
Министерство здравоохранения Российской Федерации
Российский государственный медицинский университет
Рекомендуется Учебно-методическим обьединением по медицинскому
и фармацевтическому образованию вузов России в качестве учебного
пособия для студентов, обучающихся на медико-биологических
факультетах медицинских вузов
УДК 546(075.8)
В.В.Теплов Комплексные соединения.
Учебное пособие.-М.,РГМУ, 2003, 160с. с илл.
Рецензенты:
академик РАЕН, проф. С.В. Мещеряков (РГУ нефти и газа им. И.М.Губкина)
проф. А.П.Каплун (Московская государственная академия тонкой химической технологии им. М.В.Ломоносова)
Автор благодарен проф. МещеряковуС.В. и проф. Каплуну А.П., а также доценту кафедры неорганической химии МГАТХТ им. М.В.Ломоносова Кудряшовой З.А. за ряд ценнных замечаний, сделанных ими при просмотре рукописи. Особую благодарность автор выражает проф. Захарченко В.Н. за постоянное внимание к работе автора над этой книгой.
ISBN 5-88458-115-7
© Российский государственный медицинский университет, 2003
Значение координационных (комплексных) соединений во всех отраслях химии как прикладного, так и теоретического характера всё время возрастает. Это вполне понятно, если учесть, что большинство известных нам соединений можно отнести к классу координационных. Многообразие координационных соединений поистине безгранично - от иона аммония до полиядерных комплексов и сложных металлоорганических соединений. Особое значение химия координационных соединений приобретает при изучении и исследовании металлоферментов и других биологически важных соединений, функционирование которых связано с присутствием металлов. Процессы, регулируемые ионами металлов, пронизывают все науки о жизни. Важнейшие
процессы, благодаря которым существует сама жизнь, протекают с участием координационных соединений. Это, например, процессы фотосинтеза с участием хлорофилла - разложение углекислого газа с выделением кислорода. Невозможен без участия координационных соединений процесс фиксации азота из воздуха, благодаря которому азот переходит в формы, которые могут усваиваться живыми организмами.
Ионы железа, магния, марганца, меди, молибдена, цинка входят в состав ферментов, катализирующих такие реакции, как перенос групп, окислительно-восстановительные или гидролитические процессы. Так, ионы железа являются кофакторами цитохромоксидазы, каталазы и пероксидазы; ионы цинка – карбоангидразы, ДНК-полимеразы, алкогольдегидрогеназы; ионы магния – гексокиназы, глюкозо-6-фосфатазы и т.д.
Ионы других металлов, хотя находятся в значительно меньших количествах, координационно связаны с различными биологически важными соединениями, имеющими большое биологическое значение.
Поэтому изучение химии координационных соединений чрезвычайно важно для понимания процессов, проходящих в живом организме.
Глава 1. Основные положения координационной теории
1.1. Определение комплексных соединений
Основатель координационной теории строения комплексных соединений А.Вернер делил все химические соединения на соединения первого порядка, построенные согласно классической теории валентности (простые или атомные соединения типа HCl, H2O, NH3, CH4, CoCl3) и соединения высшего порядка (или молекулярные). Соединения высшего порядка, согласно А. Вернеру, представляют собой продукты сочетания соединений первого порядка, например:
NH3 + HCl = [NH4]Cl.
KF + BF3 = K[BF4].
AgCl + 2NH3 = [Ag(NH3)2] Cl.
CrCl3 + 6H2O = [Cr(H2O)6] Cl3.
Fe(CN)3 + 3KCN = K3[Fe(CN)6].
Молекулярные соединения (соединения высшего порядка) называются комплексными или координационными соединениями.
Различить комплексные и простые соединения иногда очень трудно. В зависимости от условий одно и то же соединение можно рассматривать и как простое, и как комплексное. Так, галогениды щелочных и щелочно-земельных металлов, которые в газообразном состоянии существуют в виде отдельных молекул, в твёрдом состоянии ассоциированы. В растворе эти соединения диссоциируют на простые ионы. Хлорид натрия в кристаллическом состоянии следует рассматривать как высокомолекулярное комплексное соединение (NaCl)n. Вода в парообразном состоянии отвечает формуле H2O, а в жидком состоянии - формуле (H2O)n. И с точки зрения химической связи различие между простыми и комплексными частицами обычно отсутствует.
Из-за огромного разнообразия комплексных соединений и их характерных свойств чёткого определения «комплексное соединение» не существует. Но поскольку в лабораторной практике химики чаще всего имеют дело с соединениями в твёрдом или растворённом состояниях, то комплексными или координацион-
ными соединениями принято называть соединения, в узлах кристаллической решётки которых находятся комплексы, способные к самостоятельному существованию в растворе.
1.2. Основные понятия
Согласно координационной теории в молекуле любого комплексного соединения различают центральный атом или ион- комплексообразователь, вокруг которого в непосредственной близости координировано некоторое число противоположно заряженных ионов или электронейтральных молекул, называемых лигандами. Центральный атом- комплексообразователь и лиганды образуют внутреннюю координационную сферу. Ионы, не разместившиеся во внутренней сфере, составляют внешнюю координационную сферу. При написании формул комплексных соединений центральный атом вместе с лигандами заключают в квадратные скобки. Внутренняя сфера комплекса в значительной степени сохраняет стабильность при растворении, а ионы, находящиеся во внешней сфере, легко отщепляются. Внешняя сфера комплексного соединения может состоять из катионов, если комплексный ион является анионом, или анионов, если комплексный ион является катионом, и может совсем отсутствовать, если заряд комплекса равен нулю. Заряд комплексного иона равен алгебраической сумме зарядов комплексообразователя и лигандов. При расчёте заряды молекул принимаются равными нулю.
Общее число электродонорных центров лигандов (атомов или π-связей), координированных центральным атомом, называется координационным числом. В качестве центрального атома-комплексообразователя могут выступать практически любые химические элементы, но наиболее прочные комплексы образуют
d-элементы.
Координационная формула комплексного соединения устанавливается экспериментально. В частности, исследование электропроводности водных растворов комплексных соединений позволяет определить число ионов, на которое распадается молекула комплексного соединения (рис. 1).
Сопоставление данных по эквивалентной электропроводности растворов исследуемых соединений с результатами химического анализа, показывающего, какие ионы находятся во внешней координационной сфере, а также их количество, позволяет определить структуру комплексного соединения.
Подобным образом были доказаны структуры следующих комплексных соединений, получившихся при замещении при постепенном замещении в комплексном соединении [Pt(NH3)6]Cl4 молекул аммиака на ионы хлора: [Pt(NH3)6]Cl4, [Pt(NH3)5Cl]Cl2, [Pt(NH3)4Cl2]Cl2,[Pt(NH3)3Cl3]Cl, [Pt(NH3)2Cl4], K[Pt(NH3)Cl5], K2[PtCl6].
На рис.1 показано, как с изменением числа ионов, на которые распадается молекула, эквивалентная электропроводность сначала уменьшается, для соединения [Pt(NH3)2Cl4] практически равна нулю, а потом начинает увеличиваться.
λ Ом-1· м2 · моль экв-1

Рис.1. Зависимость эквивалентной электропроводности λ от количества ионов «n», на которые распадается молекула комплексного соединения платины(IV), содержащей в качестве лигандов ионы хлора и молекулы аммиака.
Координационная формула комплексного соединения, находящегося в кристаллическом состоянии, может быть непосредственно установлена рентгеноструктурным методом. По дифракционной картине (рентгенограмме), полученной при прохождении рентгеновских лучей через кристаллические комплексные соединения, можно судить, какие атомы, ионы или молекулы образуют кристаллическую решётку, а также, как они расположены в пространстве.
Выше были рассмотрены одноядерные комплексы. Во внутренней сфере такого комплекса находится один центральный атом-комплексообразователь и некоторое число лигандов, при наличии же во внутренней сфере нескольких центральных атомов это будет многоядерный комплекс. Например, [PdCl6]2- - одноядерный комплекс, а [Os3(CO)12] – трёхядерный.
Лиганды могут координироваться центральным атомом за счёт образования σ-,(σ,π)- или только многоцентровых π-связей. Соответственно их называют σ-,(σ,π)- и π-лигандами. Если лиганды соединяются с центральным атомом одним атомом-донором, это монодентатные лиганды. К ним относятся анионы Cl-,Br-, S2-,CN-, SCN-, нейтральные молекулы H2O,NH3 и многие другие. Лиганды, которые могут соединяться с центральным атомом-комплексообразователем в зависимости от условий различными донорными атомами, называются амбидентатными. Например, у лиганда –SCN- донорным атомом может быть либо S,либо N.
Для комплексных соединений с монодентатными лигандами координационное число центрального атома равно числу лигандов. Например, в комплексном соединении K2[PtCl6] центральным атомом-комплексообразователем является платина в степени окисления +4, во внутреннюю сферу входят 6 анионов хлора. Координационное число центрального атома равно 6. Комплексный ион представляет собой анион, заряд которого равен +4 - 6= -2.Во внешней сфере находятся 2 иона калия. В комплексном соединении [Pt(NH3)4Cl2]Cl2 центральным атомом - комплексообразователем также является платина в степени окисления +4, во внутреннюю сферу входят 4 молекулы аммиака,2 аниона хлора. Координационное число центрального атома также равно 6. Комплексный ион представляет собой катион, заряд которого равен +4 +0 –2 = +2. Во внешней сфере находятся 2 иона хлора.
В комплексном ионе лиганды могут быть связаны с центральным атомом посредством не только одного, но и нескольких атомов. Число донорных центров лиганда, образующих координационные связи с центральным атомом (т.е. число σ-связей, форми-
руемых одним σ- или (σ,π)-лигандом с центральным атомом), называется дентатностью (от лат. dentalus – имеющий зубы). Для π-лигандов понятие дентатность не применяется.
Этилендиамин (сокращённое обозначение en), двухзарядные ионы C2O42-, S2O32-,CO32-,SO42- и им подобные относятся к бидентатным лигандам. Примеры комплексных соединений Со3+ с этими лигандами:
Na3[Co(C2O4)3], [Co(en)3](NO3)3, Ca3[Co(S2O3)3]2.
Лиганды могут быть также тридентатными, тетрадендатными, … полидентатными. Для комплекса с полидентатными лигандами координационное число равно числу таких лигандов, умноженному на дентатность.
Лиганды, координирующиеся через два или более донорных атомов к одному центральному атому, образуя один или несколько гетероциклов, называются хелатными. Замыкание хелатного цикла такими лигандами называется хелатированием (хелатообразованием), например, катион бисэтилендиаминмедь(II)
(рис.3).
Лиганды, координирующиеся к различным центральным
атомам или ионам, называются мостиковыми, например:
m-дихлоро-бис-(h -аллил)дипалладий(II) (рис. 2).
Существуют многоядерные комплексы, в которых центральные атомы непосредственно связаны меду собой. Такие комплексы называются кластерами, например: [(CO)5Mn-Mn(CO)5].
1.3. Номенклатура комплексных соединений
Номенклатура комплексных соединений является составной частью номенклатуры неорганических веществ. Правила составления названий комплексных соединений являются систематическими (однозначными). В соответствии с рекомендациями ИЮПАК эти правила универсальны, так как при необходимости могут быть применены и к простым неорганическим соединениям, если для последних отсутствуют традиционные и специальные названия. Названия, построенные по систематическим правилам, адекватны химическим формулам. Формула комплексного соединения составляется по общим правилам: сначала пишется катион - комплексный или обычный, затем анион - комплексный или обычный. Во внутренней сфере комплексного соединения сначала пишут центральный атом-комплексообразователь, затем незаряженные лиганды (молекулы), затем отрицательно заряженные лиганды-анионы.
Одноядерные комплексы
В названиях катионных, нейтральных и большинства анионных комплексов центральные атомы имеют русские наименования соответствующих элементов. В некоторых случаях для анионных комплексов используют корни латинских наименований элементов центрального атома-комплексообразователя. Например, [Pt(NH3)2Cl2] – дихлордиамминплатина, [PtCl4]2- - тетрахлороплатинат(II) –ион, [Ag(NH3)2]+ - катион диамминсеребра(I), [Ag(CN)2]- - дицианоаргенат(I)-ион.
Название комплексного иона начинают с указания состава внутренней сферы. Прежде всего, в алфавитном порядке перечисляют находящиеся во внутренней сфере анионы, прибавляя к их латинскому названию окончание «о». Например, ОН-– гидроксо, Cl- - хлоро, CN -- циано,CH3COO- - ацетато,CO32- - карбонато,C2O42- -оксалато,NCS- -тиоцианато,NO2- -нитро, O22- - оксо, S2- - тио,SO32- - сульфито, SO3S2- - тиосульфато,C5H5 – циклопентадиенил и т.д. Затем в алфавитном порядке указывают внутрисферные нейтральные молекулы. Для нейтральных лигандов используются однословные названия веществ без изменений, например N2 -диазот,N2H4 -гидразин, С2Н4 - этилен. Внутрисферные NH3 называют аммино-, H2O – аква, CO- карбонил, NO- нитрозил. Число лигандов указывают греческими числительными: ди, три, тетра, пента, гекса и т.д. Если названия лигандов более сложные, например, этилендиамин, перед ними ставят префиксы «бис», «трис», «тетракис» и т.д.
Названия комплексных соединений с внешней сферой состоят из двух слов (в общем виде «анион катиона»). Название комплексного аниона заканчивается суффиксом–ат. Степень окисления комплексообразователя указывают римскими цифрами в скобках после названия аниона. Например:
K2[PtCl4] – тетрахлороплатинат(II) калия,
Na3[ Fe(NH3)(CN)5] – пентацианомоноамминферрат(II) натрия,
H3O[AuCl4] – тетрахлороаурат(III) оксония,
K[I(I)2] – дииодоиодат(I) калия,
Na2[Sn(OH)6] – гексагидроксостаннат(IV) натрия.
В соединениях с комплесным катионом степень окисления комплексообразователя указывают после его названия римскими цифрами в скобках. Например:
[Ag(NH3)2]Cl – хлорид диамминсеребра (I),
[Pt(NH3)3Cl3]Br – бромид трихлоротриамминплатины(IV),
[Co(NH3)4(NO2)Cl]NO3 -
нитрат хлоронитротетраамминкобальта(III).
Названия комплексных соединений – неэлектролитов без внешней сферы состоят из одного слова, степень окисления комплексообразователя не указывается. Например:
[Co(H2O)3 F3] – трифторотриаквокобальт,
[Pt(NH3)2Cl4]- тетрахлородиаммин платина,
[Fe(C5H5)2] – бис (циклопентадиенил)железо.
Название соединений с комплексными катионом и анионом складывается из названий катиона и аниона, например:
[Co(NH3)6][Co(NO2)6] -
гексанитрокобальтат(III) гексаамминкобальта(III),
[Pt(NH3)3Cl][PtNH3Cl3] –
трихлороамминплатинат (II) хлоротриаммин платины(II).
Для комплексов с амбидентатными лигандами в названии указывается символ атома, с которым этот лиганд связан с центральным атомом-комплексообразователем:
[Co(-NCS)4]2- - тетракис(тицианато-N) кобальтат(II) –ион,
[Hg(-SCN)4]2- - тетракис(тиоцианато-S) меркурат(II) – ион.
По традиции амбидентатный лиганд NO2- называют нитро-лигандом, если донорным атомом является азот, и нитрито-лигандом, если донорным атомом является кислород (–ONO-):
[Co(-NO2)6]3- - гексанитрокобальтат(III)-ион,
[Co(-ONO)6]3- - гексанитритокобальтат(III)-ион.
Многоядерные комплексы
Перед названиями мостиковых лигандов ставят префикс m-, перед ненасыщенными – префикс h-.
Например:[Br2AlBr2AlBr2] –ди (m- бромо)бис(дибромоалюминий),
K2[Cl4Re-ReCl4] –бис{тетрахлороренат(III)}калия.
Если все атомы лиганда связаны с центральным атомом, цифровой индекс у h не ставится. Например,
m-дихлоро-бис-(h -аллил)дипалладий(II) (рис. 2):



Рис.2. m-дихлоро-бис-(h -аллил)дипалладий(II).
1.4. Классификация комплексных соединений
Комплексные ионы могут входить в состав молекул различных классов химических соединений: кислот, оснований, солей и др. В зависимости от заряда комплексного иона различают катионные, анионные и нейтральные комплексы.
Катионные комплексы
В катионных комплексах центральным атомом-комплексо-образователем являются катионы или положительно поляризованные атомы комплексообразователя, а лигандами - нейтральные молекулы, чаще всего воды и аммиака. Комплексные соединения, в которых лигандом выступает вода, называются аквакомплексами. К таким соединениям относятся кристаллогидраты. Например: MgCl2 ×6H2O или [Mg(H2O)6]Cl2, CuSO4 ×5H2O или [Cu(H2O)4] SO4 Н2O, FeSO4 ×7H2O или [Fe(H2O)6]SO4 ×H2O
В кристаллическом состоянии некоторые аквакомплексы (например, медный купорос) удерживают и кристаллизационную воду, не входящую в состав внутренней сферы, которая связана менее прочно и легко отщепляется при нагревании.
Один из наиболее многочисленных классов комплексных соединений - амминокомплексы (аммиакаты) и аминаты. Лигандами в этих комплексах являются молекулы аммиака или амина. Например: [Cu(NH3)4]SO4, [Pt(NH3)6]Cl4,
[Cd(NH2CH2CH2NH2)3]Cl2.
Анионные комплексы
Лигандами в таких соединениях являются анионы или отрицательно поляризованные атомы и их группировки.
К анионным комплексам относятся:
а) комплексные кислоты H[BF4], H2[SiF6], H[Ag(CN)2].
б) двойные и комплексные соли PtCl4 ×2KCl или K2[PtCl6],
HgI2·×2KI или K2[HgI4].
в) кислородсодержащие кислоты и их соли H2SO4, K2SO4, H5IO6, K2CrO4.
г) гидроксосоли K[Al(OH)4], Na2[Sn(OH)6].
д) полигалогениды: K[I(I)2], Cs[I(I2)4].
Нейтральные комплексы
К подобным соединениям относятся комплексные соединения, не имеющие внешней сферы и не дающие в водных растворах комплексных ионов: [Pt(NH3)2Cl4], [Co(NH3)3(NO2)3], карбонилкомплексы [Fe(CO)5], [W(CO)6].
Катионно-анионные комплексы
Соединения одновременно содержат как комплексный катион, так и комплексный анион:
[Pt(NH3)4][PtCl4], [Ni(NH3)6][Fe(CN)6].
Циклические комплексы (хелаты)
Координационные соединения, в которых центральный атом (или ион) связан одновременно с двумя или более донорными атомами лиганда, в результате чего замыкается один или несколько гетероциклов, называются хелатами. Лиганды, образующие хелатные циклы, называются хелатирующими (хелатообразующими) реагентами. Замыкание хелатного цикла такими лигандами называется хелатированием (хелатообразованием). Наиболее обширный и важный класс хелатов – хелатные комплексы металлов. Способность координировать лиганды присуща металлам всех степеней окисления. У элементов основных подгрупп центральный атом-комплексообразователь обычно находится в высшей степени окисления.
Хелатирующие реагенты содержат два основных типа электродонорных центров: а)группы, содержащие подвижный протон, например, -COOH, -OH, -SO3H; при их координации к центральному иону возможно замещение протона и б)нейтральные электронодонорные группы, например R2CO, R3N. Бидентатные лиганды занимают во внутренней координационной сфере хелата два места, как, например, этилендиамин (рис.3).
Согласно правилу циклов Чугаева, наиболее устойчивые хелатные комплексы образуются в том случае, когда в состав цикла входит пять или шесть атомов. Например, среди диаминов состава H2N-(CH2)n-NH2 наиболее устойчивые комплексы образуются для n=2 (пятичленный цикл) и n=3 (шестичленный цикл).

Рис.3. Катион бисэтилендиамин меди(II).
Хелаты, в которых при замыкании хелатного цикла лиганд использует протон-содержащую и нейтральную электронодонорные группы и формально связан с центральным атомом ковалентной и донорно-акцепторной связью, называ ются внутрикомплексными соединениями. Так, полидентатные лиганды с кислотными функциональными группами могут образовывать внутрикомплексные соединения. Внутрикомплексные соединения – это хелат, в котором замыкание цикла сопровождается вытеснением из кислотных функциональных групп одного или нескольких протонов ионом металла, в частности, внутрикомплексным соединением является глицинат меди(II):

8-Оксихинолин образует с двухзарядными ионами внутрикомплексные соединения тетраэдрической конфигурации, а с трёхзарядными – октаэдрической (рис.4).И те, и другие не заряжены и малорастворимы в воде. В качестве примера можно привести труднорастворимую в воде соль цинка (рис. 4):
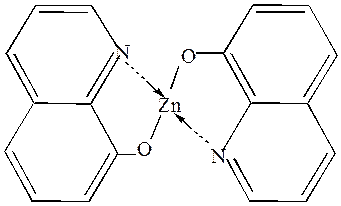
Рис.4. Внутрикомплексное соединение 8-оксихинолина с цинком.
Гемоглобин и хлорофилл также являются внутрикомплексными соединениями.
Важнейшая особенность хелатов – их повышенная устойчивость по сравнению с аналогично построенными нециклическими комплексами.
Следует выделить комплексы с макроцикличекими лигандами
Макроциклические лиганды - это гетероциклические соединения, содержащие несколько донорных атомов, связанных мостиками таким образом, что образуется полость определённого размера
Такие лиганды образуют ещё более устойчивые комплексы, в частности даже с ионами щелочных металлов (рис. 21).
Полиядерные комплексы
Комплексы, в которых лиганды связывают два или более центральных атомов, называются би - или полиядерными. В качестве примера можно привести биядерные комплексы кобальта(III): с
одной мостиковой гидроксогруппой - [(NH3)5Co-OH-Co(NH3)5]Cl5
и с двумя мостиковыми гидроксогруппами-
[(NH3)4Co -(OH)2-Co(NH3)4]Cl4 (рис.5):

а) б)
Рис.5. Биядерные комплексы Co(III):
а)с одной мостиковой гидроксогруппой
[(NH3)5Co-OH-Co(NH3)5]Cl5
б)с двумя мостиковыми гидроксогруппами
[(NH3)4Co -(OH)2-Co(NH3)4]Cl4.
Если полиядерные комплексы имеют химические связи между центральными атомами, такие комплексы называются кластерами. Например, октакарбонилдикобальт [Co2(CO)8](рис. 6):

Рис.6. Октакарбонилдикобальт.
Внешнесферные комплексы
Многие комплексы могут присоединять дополнительные ионы или молекулы, не связанные непосредственно с центральным атомом. Такие комплексы называются внешнесферными. Лиганды, находящиеся во внешней сфере, удерживаются, главным образом, электростатическими силами. Помимо электростатических взаимодействий, дополнительная стабилизация может иметь место за счёт образования водородных связей, переноса заряда и донорно-акцепторных взаимодействий между лигандами внутренней и внешней сфер. Эти специфические взаимодействия лигандов проявляются, например, в изменении окраски при образовании внешнесферного комплекса. Так, комплекс серебра с бромпирогаллоловым красным окрашен в жёлтый цвет, а в присутствии фенантролина образуется голубой комплекс состава
|
|
Дата добавления: 2017-02-01; Просмотров: 119; Нарушение авторских прав?; Мы поможем в написании вашей работы!