
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
И констант равновесия химических реакций
|
|
|
|
Вычисление стандартной энергии Гиббса
по таблицам термодинамических величин
Итак, для определения направления химического процесса в системе данного состава необходимо знать величину константы равновесия при заданной температуре. Методы ее расчета основаны на следующем фундаментальном уравнении термодинамики:
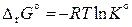 ,
,  . (11.51)
. (11.51)
По сути дела вычисление константы равновесия сводится к определению стандартной энергии Гиббса реакции при выбранной температуре.
Стандартные энтальпия и энтропия реакции при 298,15 К расчитываются через стандартные энтальпии образования и абсолютные энтропии участников реакции по соотношениям
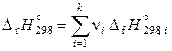 ,
, 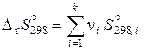 . (11.52)
. (11.52)
Стандартная энергия Гиббса реакции при 298,15 К равна
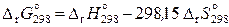 . (11.53)
. (11.53)
В расчетах при 298,15 К можно воспользоваться величинами стандартных энергий Гиббса образования химических соединений:
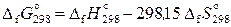 . (11.54)
. (11.54)
Энергия Гиббса – функция состояния, поэтому ее изменение не зависит от пути протекания реакции, а определяется только природой и состоянием продуктов реакции и исходных веществ. Следовательно, стандартная энергия Гиббса реакции может быть вычислена (как и тепловой эффект) по закону Гесса:
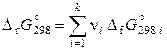 . (11.55)
. (11.55)
Значения стандартной энергии Гиббса образования веществ при 298,15 К табулированы в справочниках термодинамических и физико-химических свойств (например, табл. 44, стр. 72).
Вычисление константы равновесия реакции при температурах, отличных от 298,15 К, возможно на основе констант равновесия реакций образования веществ, участвующих в реакции. Константа равновесия реакции образования и стандартная энергия Гиббса образования i -го участника реакции связаны соотношением
 . (11.56)
. (11.56)
Стандартная энергия Гиббса реакции при заданной температуре Т вычисляется по уравнению, аналогичному (11.55):
|
|
|
 . (11.57)
. (11.57)
С другой стороны,
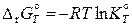 .
.
Следовательно,
 ,
,
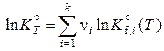 . (11.58)
. (11.58)
В справочниках физико-химических величин (напр., табл. 49, стр. 97) обычно приводятся значения десятичных логарифмов констант равновесия реакций образования, относящихся к образованию соединений из простых веществ, устойчивых при 1 атм и 298,15 К. Поэтому на практике используется уравнение
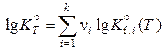 . (11.58)
. (11.58)
Стандартные энергии Гиббса образования простых веществ и логарифмы констант равновесия реакций их образования равны нулю:
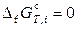 ,
,  .
.
Наиболее часто для вычисления констант равновесия реакций при температурах, отличных от 298,15 К, применяют энтропийные методы, основанные на использовании следующего соотношения:
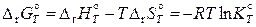 . (11.59)
. (11.59)
Энтальпия и энтропия реакции при заданной температуре вычисляются по уравнениям
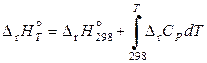 , (11.60)
, (11.60)
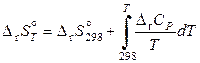 . (11.61)
. (11.61)
Если известны температурные зависимости теплоемкости всех участников реакции, то уравнения (11.59) и (11.60) принимают следующий вид:
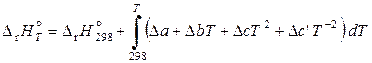 , (11.62)
, (11.62)
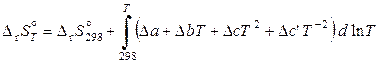 . (11.63)
. (11.63)
При отсутствии данных по теплоемкостям веществ и (или) их температурным зависимостям используют приближенные методы расчета. В самом грубом приближении принимают, что
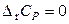 .
.
Тогда
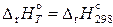 ,
,  ,
,
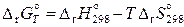 . (11.64)
. (11.64)
Погрешность подобных расчетов может достигать 100 %, что приводит к ошибке на порядок в вычислении константы равновесия.
Второе приближение используют, если известны теплоемкости веществ при 298,15 К, но отсутствуют данные по их температурным зависимостям. Принимают, что
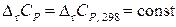 .
.
Следовательно,
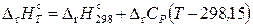 ;
;
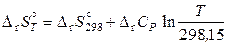 ;
;
 ;
;
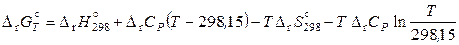 ;
;
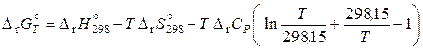 ;
;
 . (11.65)
. (11.65)
Значения величины

при различных температурах приводятся в справочниках (напр., табл. 45, стр. 92).
Число операций, необходимое для расчета стандартной энергии Гиббса реакции на основе уравнений (11.62) и (11.63), значительно сокращается при использовании метода Темкина – Шварцмана.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1161; Нарушение авторских прав?; Мы поможем в написании вашей работы!