
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Введение. Свойства веществ и расчет изменения энтропии
|
|
|
|
Расчет количества работы.
Свойства веществ и расчет изменения энтропии.
Изменение энтропии в каком-то процессе и для какого-то вещества будем рассчитывать стандартным путем:
Δs = ∫ds.
Дифференциал энтропии явно содержится в (2.1) и (2.5):
du = T ds – pdv и dh = T ds + vdp. (2.1) и (2.5)
Обратимся снова к основным уравнениям (2.13) и (2.14), которые справедливы для любых веществ, например:
du = cvdT + (∂u/∂v)Tdv. (2.13)
Чтобы получить выражение для (∂u/∂v)T, воспользуемся (2.1): du = Tds – pdv. Разделим обе части этого уравнения на dv и потребуем неизменности температуры процесса. Получаем:
(∂u/∂v)T = T(∂s/∂v)T – p.
Исключим здесь производную (∂s/∂v)T с помощью одного из дифференциальных соотношений, которые мы просили студентов получить для тренировки:
(∂s/∂v)T = (∂p/∂T)v. Получаем:
(∂u/∂v)T = T(∂p/∂T)v – p. (2.22)
Подставим (2.22) в (2.13), получаем
du = cvdT + [T(∂p/∂T)v – p]dv. (2.23)
Из (2.1) следует, что
du = Tds – pdv → Tds = du + pdv.
Подставим (2.23) в последнее выражение:
Tds = cvdT + T(∂p/∂T)vdv → ds = cvdT / T + (∂p/∂T)vdv (2.24)
Процедуру, которую мы только что проделали с (2.1), можно провести с (2.15), только придется воспользоваться другим дифференциальным соотношением, и получим еще одну расчетную формулу для дифференциала энтропии (предлагаем студентам поделать это самостоятельно):
ds = cpdT / T – (∂v/∂T)pdp. (2.25)
Теперь осталось проинтегрировать (2.24) или (2.25), если известны зависимости сv = f(T,p), cp = f(T,v) и уравнение состояния рабочего тела F(p,v,T) = 0. Отметим, что связи (2.24) и (2.25) справедливы для любого процесса с любым рабочим веществом.
Для идеального газа pv = RуT, cv = cv(T), cp = cp(T). Тогда, пользуясь понятием средней теплоемкости (2.10) и интегрируя ds, получаем расчетные формулы для изменения энтропии в любом процессе с идеальным газом:
|
|
|
Δs = cv|t1t2ln (T2/T1) + Rуln(v2/v1) или Δs = cp|t1t2ln(T2/T1) – Rуln(p2/p1), Дж/кгК. (2.26)
Формулы (2.26) можно чуть видоизменить, если воспользоваться уравнением состояния идеального газа:
T2/T1 = p2/p1 * v2/v1 → Δs = cp|t1t2 ln(v2/v1) + cv|t1t2 ln(p2/p1). (2.27)
Эти три соотношения (2.26) и (2.27) исчерпывают связь изменения энтропии с параметрами состояния p, v, T для идеального газа в любом процессе.
«Работа – это изменение формы энергии, рассматриваемая с количественной стороны» - согласно формулировке Энгельса, данной еще в Х1Х веке. Для термодинамики это определение имеет двойное содержание: во-первых, нас будет интересовать количество работы или адекватная ей разность энергий рабочего тела, а, во-вторых, работа всегда связана с «движением», т.е. с упорядоченным перемещением вещества рабочего тела, которое взаимодействует с окружающей его средой.
Для теории, т.е. в нашем случае для термодинамики, существенна скорость взаимодействия, а она в математической терминологии предполагается бесконечно малой; также изменяются и параметры состояния. Подобные процессы («изменения состояния») уже названы (см. лекцию 1) равновесными или квазистатическими (мнимостатическими). В них в каждое мгновение перемены состояния существует равновесие между движущими силами (потенциалами) рабочего тела и окружающей среды и поэтому мы записываем dT, dp, du и т.д.
Естественно, что в подавляющем числе случаев превращения веществ, происходящих в природе и в промышленной практике, не равновесны, и поэтому необратимы в термодинамическом смысле, т.е. нельзя вернуть рабочее тело в первоначальное состояние без дополнительной затраты энергии от окружающей среды (т.е. без компенсации). Поэтому аппарат термодинамики (термостатики) в полной мере и в строгой форме к анализу действительных процессов не применим. Все же анализ подобного рода часто дает примерно верное отражение действительных изменений. Когда же глубина необратимости невелика, действительные изменения отражаются в равновесных (квазистатических) процессах достаточно точно
|
|
|
Задача расчета работы встречалась еще в школьном курсе физики, например, при расчете работы растяжения пружины или при движении груза по плоскости с трением. Для линейного перемещения работа W рассчитывается как
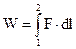 ,
,
где F – сила растяжения пружины, l – перемещение свободного конца пружины. Для объемной деформации (раздувание резинового шара и промышленного газгольдера или сжатие газа в компрессоре) работа равна
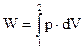 ,
,
где р – давление, V – объем газа. Даже эти два примера наводят на важную практическую мысль – количество работы прямо связано с возможностью расширения (сжатия) рабочего тела и с энергетическими резервами окружающей среды (величины движущей силы или возможности ее использования в этой среде).
В практике химических производств (а «химия – это трубы») наиболее часто применяются легко деформирующиеся рабочие тела. Сжатие и расширение газов, их нагревание и охлаждение, испарение жидкостей и конденсация паров, разделение смеси газов и многие другие превращения постоянно встречаются в инженерной практике. Особенно широко используются эти процессы в химической и нефтехимической промышленности, в энергетике. Любые технологические изменения жидкостей, паров и газов основаны на непрерывной смене состояний без возвращения к первоначальному, т.е. относятся к разряду разомкнутых процессов.
Последнее десятилетие вернуло в химии интерес к энергетике из-за резкого повышения стоимости энергоресурсов и мизерного, практически, использования вторичных энергоресурсов в собственно химических производствах. В связи с этим повысился интерес к термодинамике, как к теоретической основе преобразования энергии.
Конечной целью термодинамического расчета процесса является определение параметров состояния, изменения внутренней энергии и вычисление количеств теплоты и работы. Расчет количества работы необходим для определения и экономичного решения задачи подбора приводов дутьевых средств (машин – компрессоров, газодувок, дымососов и вентиляторов для транспортировки газов и паров).
|
|
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 414; Нарушение авторских прав?; Мы поможем в написании вашей работы!