
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Частные случаи Ι Закона термодинамики
|
|
|
|
I. Изохорный процесс: V=const.
Предположим, что система не совершает работу, кроме механической:

Применяя данный случай к химическим реакциям, говорят, что тепловой эффект химической реакции при постоянном объеме равен изменению внутренней энергии: 
II. Изохорный процесс: P=const.

Физический смысл энтальпии – внутренняя энергия расширенной системы.

Тепловой эффект химической реакции в изобарных условиях равен изменению энтальпии системы.
III. Изотермический процесс: T=const.
Согласно молекулярно-кинетической теории (МКТ), внутренняя энергия идеального газа зависит только от температуры (Т) системы, поэтому для газовых смесей при не больших объемах производная внутренней энергии по температуре равна нулю: 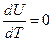 В этом случае:
В этом случае: 
 - тепло, подведенное к системе, расходуется на совершение работы.
- тепло, подведенное к системе, расходуется на совершение работы.
IV. Адиабатический процесс (процесс без теплообмена).

0= - работа совершается за счет убыли внутренней энергии.
- работа совершается за счет убыли внутренней энергии.
Применение: Дизельные двигатели. Холодильные установки.
Практическое применение I Закона термодинамики в химических реакциях.
Термохимия. Закон Гесса.
Закон Гесса: Тепловой эффект химической реакции не зависит от пути процесса.
Тепловой эффект химической реакции – энергия (тепло), выделенное или поглощенное при протекании химической реакции и одновременном соблюдении условий:
1. Реакция протекает необратимо или совершает один пробег.
2. Процесс протекает либо при постоянном давлении, либо при постоянном объеме.
3. Температура исходных веществ равна температуре продуктов.
4. Совершается только работа расширения.
Согласно этому закону, все реакции разделяются на:
1. Эндотермические, идущие с поглощением тепла
|
|
|

2. Экзотермические, идущие с выделением тепла
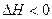
Согласно закону Гесса, наряду со стехиометрическим уравнением можно записать термохимическое, которое показывает не только соотношение реагентов в реакционной смеси, но и количество теплоты, выделившееся или поглощенное во время химической реакции.
Лекция № 2
План лекции:
- Стандартный тепловой эффект химической реакции. Методы определения.
- Теплоемкость. Виды теплоемкости.
- Закон Кирхгофа.
- методы расчета тепловых эффектов химических реакций при различных температурах.
Стандартный тепловой эффект химической реакции. Методы определения.
Стандартный тепловой эффект химической реакции – тепловой эффект химической реакции, проведенной в стандартных условиях, т.е. при t=25 (298 K) и давлении P=1 атм.(760 мм.рт.ст., 101,325 МПа).
(298 K) и давлении P=1 атм.(760 мм.рт.ст., 101,325 МПа).
Существует несколько методов расчета подобных тепловых эффектов. Все они основаны на законе Гесса.
Следствия закона Гесса.
I следствие:
Тепловой эффект химических реакций равен разности теплот сгорания исходных веществ и продуктов реакции с учетом стехиометрических коэффициентов.
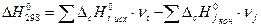
Теплота сгорания – тепловой эффект химической реакции взаимодействия 1 моль вещества с кислородом, в результате которой образуется высшие оксиды элементов, входящих в исходное соединение, кроме того: азотосодержащие горят до  ; галогеносодержащие до
; галогеносодержащие до  , водородосодержащие - до жидкой воды.
, водородосодержащие - до жидкой воды.
II следствие:
Расчет тепловых эффектов по теплотам образования:
Тепловой эффект химических реакций равен разности сумм теплот образования продуктов и исходных веществ с учетом стехиометрических коэффициентов.

Стандартная теплота образования – Общий тепловой эффект химической реакции образования 1 моль вещества из простых веществ, взятых в устойчивых состояниях.
Реакции, тепловой эффект которых отвечает теплотам образования, могут не реализовываться на практике:
|
|
|

|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 418; Нарушение авторских прав?; Мы поможем в написании вашей работы!