
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Спектральные серии излучения атомарного водорода
|
|
|
|
В 1885 г. И.Бальмер установил, что длины известных линий спектра атома водорода в видимой области спектра могут быть вычислены по формуле:
 , где n = 3, 4, 5, …;
, где n = 3, 4, 5, …;  – постоянная Ридберга.
– постоянная Ридберга.
Эту формулу можно переписать, используя соотношение  (
( – собственная частота,
– собственная частота,  – длина волны, с – скорость света) так:
– длина волны, с – скорость света) так:
 , где R = 3,28985.1015 с-1 –также называется постоянной Ридберга.
, где R = 3,28985.1015 с-1 –также называется постоянной Ридберга.
Все линии, отличающиеся различными значениями n, образуют группу или серию линий, называемую серией Ба‘льмера.
Ридберг показал, что в линейных спектрах элементов наблюдаются спектральные серии, причем ν всех линий данной серии удовлетворяют соотношению: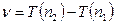 , где n 2 и n 1 – целые числа. Величины T (n 2) и T (n 1) называют спектральные термы. Для данной серии n 2 имеет постоянное значение 2. Для серии Бальмера:
, где n 2 и n 1 – целые числа. Величины T (n 2) и T (n 1) называют спектральные термы. Для данной серии n 2 имеет постоянное значение 2. Для серии Бальмера:  ,
,  .
.
В 1908 году Ритцем был изложен комбинационный принцип: частоты спектральных линий излучения любого атома могут быть представлены в виде разности двух термов; составляя различные комбинации термов, можно найти все возможные частоты спектральных линий этого атома.
В 1908 г. Пашеном обнаружены серии линий спектра водорода в инфракрасной области:
 n = 4, 5, 6, …; – серия Пашена;
n = 4, 5, 6, …; – серия Пашена;
В ультрафиолетовой области:
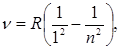 n = 2, 3, 4,…; – серия Лаймана;
n = 2, 3, 4,…; – серия Лаймана;
В далекой инфракрасной области:
 n = 5, 6, 7,…; – серия Брекета;
n = 5, 6, 7,…; – серия Брекета;
 n = 6, 7, 8, …; – серия Пфунда;
n = 6, 7, 8, …; – серия Пфунда;
 n = 7, 8, 9, …; – серия Хэмфри.
n = 7, 8, 9, …; – серия Хэмфри.
Общую формулу можно записать в следующем виде:
 n = m + 1, m + 2.
n = m + 1, m + 2.
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 3126; Нарушение авторских прав?; Мы поможем в написании вашей работы!