
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Склад та характеристика рідкої суміші
ФАЗОВІ ПЕРЕТВОРЕННЯ ВУГЛЕВОДНЕВИХ СИСТЕМ
Склад рідкої суміші характеризується масовими або молярними концентраціями компонентів.
Середня молекулярна маса рідкої суміші визначається за формулами, як і склад газової суміші:
| Мсум. = (у1М1+ у2М2 +…. + упМп) / 100. | (5.1) |
Середня густина рідкої суміші рсум. (в кг/м3) визначається за формулою:
| ρсум = 100/(g1/ρ1 + g2/ρ2+…+ gп/ρп) = 100 Мсум./(х1М1/ρ1+х2М2/ρ2 +.. +хпМп/ρп), | (5.2) |
де g1, g2, gп - масові вмісти компонентів рідкої суміші, в %;
х1, х2,..., хп - молярні вмісти компонентів рідкої суміші, в %;
М1, М2,.... Мп - молярні маси компонентів;
Мсум. - середня молекулярна маса рідкої суміші;
ρ1, ρ2,..., ρп - густини компонентів рідкої суміші, кг/м3.
Речовина залежно від тиску та температури може існувати (перебувати) у газоподібному чи рідкому стані. Поняття "пара" визначається як газоподібний стан будь-якої речовини, яка в звичайних умовах є рідиною чи твердим тілом. Під звичайними умовами необхідно розуміти атмосферні умови, тобто атмосферні тиск і температура. Під час розгляду вугле-воднів зручно вважати синонімами поняття "газ" та "пара".
Вуглеводневі системи можуть бути гомогенними або гетерогенними.
У гомогенній системі всі її частини мають однакові фізичні та хімічні властивості.
У гетерогенній системі фізико-хімічні властивості в різних точках різні. Гетерогенні системи складаються з фаз. Фаза - це певна частина системи, яка є гомогенною і фізично відокремлена від інших фаз чіткими границями.
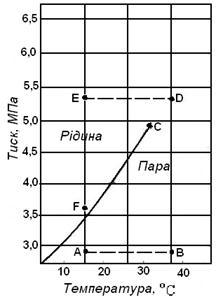
Якприклад гомогенної (однокомпонентної) системи вибираємо газ етан. За деяких умов він може існувати у вигляді рідини, хоча в більшості випадків знаходиться в газоподібному стані. Діаграма фазового стану етану в залежності від тиску і температури наведена на рисунку 5.1.
|
Рисунок 5.1 – Діаграма фазового стану етану в координатах тиск-температура
На діаграмі показана крива тиску насиченої пари. Насичена пара - це двофазна система (суміш рідини та пари) з граничними умовами х = 0 і х = 1, де х - паровміст суміші (тиск та температура повинні бути такими, щоб речовина знаходилась у двофазному стані). Для етану в умовах тиску та температури, які відповідають кривій, рідина та її пара перебувають у рівновазі. При будь-яких інших тисках та температурах, які не відповідають точкам цієї кривої, речовина перебуває в однофазному стані - рідкому або газовидному.
З рисунка видно, при яких значеннях тиску та температури етан знаходиться в тому чи іншому стані (рідкому чи газоподібному).
Не зважаючи на те, що умови існування рідини та пари не змінюються, енергія всієї системи збільшується в міру того, чим більша кількість речовини переходить із нижнього енергетичного рідинного стану у високоенергетичний газо-подібний стан. Температура кипіння рідини є функцією тиску.
Точка С, яка обмежує криву тиску насиченої пари, відома як критична точка системи. В однокомпонентній системі критична точка визначається найбільшими значеннями тиску та температури, при яких ще можуть співіснувати дві фази.
Для багатокомпонентних систем визначення критичної точки виглядає таким чином: Критична точка - це такий стан тиску та температури, при якому властивості газоподібної та рідкої фаз стають однаковими.
Іншою ілюстрацією поведінки однокомпонентної системи (етану) є графік на рисунку 5.2, на якому незалежними параметрами є тиск і питомий об'єм.
| тиск, МПа | 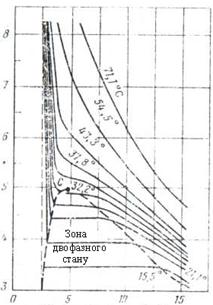
|
| питомий об’єм, 10-3 м3/кг |
Рисунок 5.2 – Діаграма фазового стану етану в координатах тиск-питомий об’єм
Тут ділянка (область) одночасного існування двох фаз виражена більш чітко - виділена штриховою лінією. Точка С - критична точка. Для етану критична температура дещо більша 32°С, а критичний тиск ~ 5 МПа. Суцільні лінії - ізотерми (лінії рівних температур). Зліва від точки С (лінія проходить через т. С і т. О) - крива точок початку кипіння. Праворуч від т. С (лінія проходить через т. С і т. Н) - крива точок роси. Ділянка, яка обмежена цими двома кривими, є двофазною ділянкою.
З наближенням тиску та температури до їх критичних значень властивості газової та рідкої фаз наближаються і стають однаковими - поверхня розділу між ними зникає.
Для ізотермічних фазових перетворень однокомпонентних газів характерною є постійність тиску у двофазній ділянці (області). Горизонтальні відрізки у двофазній ділянці відповідають незмінності тиску в процесі конденсації парової фази в рідку. Величина цього тиску називається пружністю насиченої пари при температурі (або при різних температурах, що вказані на малюнку).
За різних умов всередині двофазної ділянки кількість речовини, яка перебуває у газоподібному (паровому) та рідкому стані, може бути визначеною через питомий об'єм суміші газу та рідини.
Підсумовуючи вищесказане про однокомпонентні та дво- (і більше) компонентні системи, необхідно відзначити наступне:
Окремо взятий вуглеводневий компонент природного газу може бути переведений в рідкий стан за умови підвищення тиску або зниження температури.
Конденсація його можлива в області докритичних температур та тисків. За межами критичних параметрів (в області високих тисків та температур) різниця між рідиною і парою (газом) зникає і вуглеводень знаходиться в одно-фазному стані.
Пряме випарювання чистого вуглеводню відбувається за умови зниження тиску та підвищення температури. Прямі процеси конденсації та випарювання відбуваються стрибкоподібно, обминаючи двофазний стан.
Суміш парів вуглеводнів може бути повністю сконденсована під час переходу через проміжний двофазний стан. Критичні параметри такої суміші відрізняються від критичних параметрів окремих компонентів, які змінюються залежно від тиску та температури.
Діаграма фазового стану суміші вуглеводнів в координатах тиск – температура наведена на рисунку 5.3.
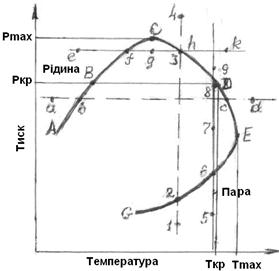
Рисунок 5.3 – Діаграма фазового стану суміші вуглеводнів
в координатах тиск-температура
У докритичній області вуглеводнева суміш підпорядковується закону прямої конденсації, яка за умови ізотермічного підвищення тиску протікає у звичайній послідовності, що означає: від пари (1-2) через двофазний стан (2-3) до рідини (3-4).
У зворотній послідовності протікає процес прямого випарювання під час ізобарного підвищення температури, що означає: від рідини (а-б) через двофазний стан (в-с) до пари (с-d).
В закритичній області суміш вуглеводнів поводиться незвичайно. Це було виявлено під час ізотермічного підняття тиску та ізобарного підвищення температури понад критичні параметри суміші.
Під час цього спостерігається:
а) зворотня конденсація пари суміші: від пари (5-6) через двофазний стан (6-8) знову до пари (8-9);
б) зворотне випарювання суміші: від рідини (е-f) через двофазний стан (f-h) знову до рідини (h-k).
Явища зворотної конденсації та зворотного випарювання носять назву ретроградних процесів. Особливість зворотних процесів полягає в тому, що критична температура вуглеводневої суміші не є граничною умовою існування рідкої фази, як це є в окремих вуглеводня. У цих процесах рідина випарюється з підняттям тиску (7-8) і конденсується з підвищенням температури (g-h), тобто спостерігається прямо протилежне тому, що відбувається у прямих процесах.
Якщо мають місце ретроградні явища на родовищі, то значить, що це є газоконденсатне родовище. Такі родовища характеризуються одно- або двофазним станом вуглеводневої суміші залежно від тиску та температури, відносно високими тисками та температурами, великими газовими факторами (газоконденсатними факторами), наявністю в конденсаті важких вуглеводнів.
Для характеристик фазового стану та поведінки газорідинних сумішей використовуються також константи фазової рівноваги.
Константою фазової рівноваги або коефіцієнтом розподілу і-го компонента в парову та рідку фази (Кі) називається відношення молярної долі і-го компонента в паровій фазі (уі) до його молярної долі в рідкій фазі (хі):
| Кі = уі / хі. | (5.3) |
Термін "коефіцієнт розподілу" не одержав широкого розповсюдження.
Константа фазової рівноваги визначається експериментальним та розрахунковим методами. Константи рівноваги, які визначені експериментально, не можна використовувати для іншого складу вихідної суміші.
Отже, під час експлуатації газоконденсатних чи нафтових родовищ, коли склад продукції свердловин змінюється безперервно, необхідно було б експерименти для визначення константи рівноваги виконувати також безперервно, що практично неможливо здійснити.
Розрахунковий метод полягає у використанні рівнянь стану реальних газів для визначення летючості компонентів суміші в паровій та рідкій фазах і в знаходженні константи рівноваги як відношення летючості компонента в паровій фазі до його летючості в рідкій фазі.
Летючість - це ніби дещо виправлена пружність насичених парів компонентів ідеальних розчинів або "виправлений" парціальний тиск компонентів ідеальних газових сумішей. Приблизно летючість
| f = z · Р. | (5.4) |
Така залежність дає добрі результати для газів і непридатна для рідин.
Пружність насиченої пари (тиск насиченої пари) - це така величина тиску, при якій речовина знаходиться в двофазному стані. Очевидно, що відповідною повинна бути і температура суміші вуглеводнів.
Суміші вуглеводнів не мають точних значень тиску насиченої пари, оскільки криві точок пароутворення та точок роси не співпадають між собою. Тим не менше, наприклад, для проблем зберігання нафтопродуктів поняття тиску насиченої пари є зручним. Його можна використати для підрахунку втрат рідких вуглеводнів під час випарювання та для оцінки внутрішнього тиску, який повинні витримувати резервуари.
|
Дата добавления: 2013-12-14; Просмотров: 405; Нарушение авторских прав?; Мы поможем в написании вашей работы!