
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Образования свободных радикалов, их роль в процессах трансформации примесей в тропосфере. Особенности протекания фотохимических реакций в воздухе городов
|
|
|
|
Процессы фотодиссоциации кислорода и озона приводят к почти полному поглощению солнечного излучения с длиной волны менее 300 нм на высоте тропопаузы. Поскольку основные компоненты атмосферы не взаимодействуют с излучением при λ > 300 нм, в тропосферных фотохимических реакциях участвуют лишь наименее распространенные компоненты атмосферы. Несмотря на то что средняя концентрация таких компонентов в атмосфере может быть пренебрежимо мала, в зонах хозяйственной активности локальные концентрации загрязняющих веществ могут значительно повышаться.
В химических превращениях различных загрязняющих веществ в тропосфере ключевое место занимает ОН-радикал, к образованию, которого ведут несколько процессов. Основной вклад дают фотохимические реакции с участием озона:
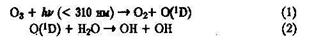
В образовании озона в тропосфере играют роль фотохимические реакции с участием оксидов азота:
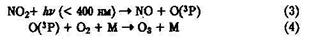
Для атомарного кислорода в основном состоянии (3Р) характерна и реакция, приводящая к разложению озона (см. § 4.2):
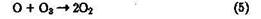
К снижению концентрации О3 в тропосфере приводит реакция
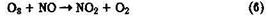
Озон участвует также в окислении NО2:
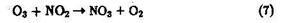
Образующийся триоксид азота неустойчив на свету и в дневное время суток распадается, в ночное время он взаимодействует с NО2 с образованием хорошо растворимого в воде N2О5:

Взаимодействуя с атмосферной влагой, N2О5 превращается в азотную кислоту:
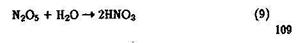
О большом влиянии фотохимических реакций на содержание озона в средних слоях тропосферы свидетельствует 50%-ное уменьшение его концентрации при солнечном затмении. Вблизи поверхности Земли стационарное содержание О3 в атмосфере в среднем составляет 0,5 мг/м3.
В образовании ОН в тропосфере наряду с О3 могут давать вклад реакции фоторазложения НNO2, НNO3, Н2О2:
|
|
|

Концентрация ОН в тропосфере составляет (0,5 - 5)·106 см-3.
Радикалы ОН в тропосфере участвуют преимущественно в реакциях с NO, NO2, СО и углеводородами. При взаимодействии ОН с оксидами азота в тропосфере образуются азотная и азотистая кислоты:

Окисление СО до СО2 — завершающая стадия окисления углеводородов и их производных в тропосфере:

Образующийся при этой атомарный водород быстро реагирует с О2 c образованием гидропероксидного радикала НО2

который играет важную роль в химии атмосферы. Образуется радикал НО2 также при взаимодействии ОН с О3 и Н2О2:
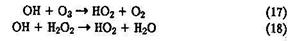
Установлено, что радикал НОг способствует возникновению фотохимического "смога", он эффективна взаимодействует с NO с образованием ОН-радикала:
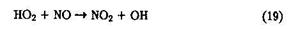
Концентрация НО2 в тропосфере составляет 107—108 см-3.
Рекомбинация НО2 — основной источник образования атмосферного пероксида водорода:
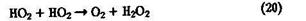
Одной из наиболее известных реакций с участием ОН является окисление углеводородов. Наиболее типичным и основным по массе органическим загрязнителем атмосферы является СН4.
Окисление СН4 под действием ОН протекает сопряженно с окислением NО. Соответствующий радикально-цепной механизм включает общую для всех тропосферных процессов стадию инициирования ОН [реакции (1, 2)] и цикл экзотермических реакций продолжения цепи, характерных для реакций окисления органических соединений
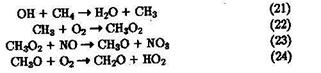 |
с последующим протеканием реакций (3), (4), (19). В результате брутто-реакции окисления СН4 в присутствии NО как катализатора в при воздействии солнечного света с длиной волны 300—400 нм запишется в виде
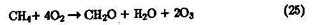
т.е. окисление метана (и других органических веществ) приводит к образованию тропосферного озона. Скорость этого процесса тем больше, чем выше концентрация NО.
Расчеты показывают, что антропогенный выброс NО удваивает приземную концентрацию О3, а рост утечки СН4, многократно опережающий по темпам роста другие виды загрязнений тропосферы, приводит к еще большему увеличению концентрации О3 по сравнению с переносом О3 из стратосферы.
|
|
|
Рост приземной концентрации озона представляет опасность для зеленой растительности и животного мира.
Образующийся при окислении СН4 формальдегид окисляется далее радикалами ОН с образованием СО. Этот канал вторичного Загрязнения атмосферы моноксидон углерода сравним с поступлением СО от неполного сгорания ископаемого топлива:
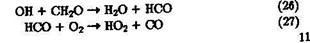

|
Формальдегид может также эффективно распадаться под действием УФ-излученил:
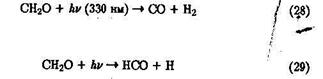
с последующим образованием НО2 - радикала [см. реакцию (16)]. Сум-марный квантовый выход реакций (28), (29) близок к единице.
Фотохимические процессы в системе О3 — NОх — Н2О — RН служат основной причиной образования так называемого фотохимического смога (см. ниже), компоненты которого — пероксиацетилнитраты (ПАН) — токсичны для человека. ПАН — название группы соединений типа
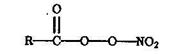
где R—СН3, С6H5 и т.д. Эти соединения образуются в результате превращений:
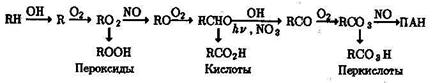
В тропосферных процессах гидроксильный радикал играет ключевую роль в окислении не только углеводородов и промежуточных продуктов их окисления, но и в окислении серосодержащих органических соединений и аминов. В частности, окисление вторичных и третичных аминов зачастую сопровождается образованней канцерогенных нитрозоаминов.
Фотохимическое окисление серосодержащих органических соединений играет ведущую роль в образовании 50; в районах, не подверженных антропогенному загрязнению.
Под действием ОН в атмосфере происходит окисление простых соединений серы, в частности Н2S и (СН3)2S. В то же время карбонил-сульфид устойчив к превращениям и просачивается в стратосферу.
|
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 2922; Нарушение авторских прав?; Мы поможем в написании вашей работы!