
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кривые комплексонометрического титрования
|
|
|
|
Кривая комплексонометрического титрования – это графическое представление зависимости концентрации определяемых катионов металла в растворе от количества (обычно — от объема) прибавляемого титранта. Часто кривые комплексонометрического титрования строятся в координатах рМ—V(Т), где рМ = -lg[Mn+] — показатель равновесной концентрации катионов Мn+ в растворе, V(T) — объем прибавленного титранта.
Кривые титрования можно также строить в координатах рМ - f, где f — степень оттитрованности раствора.
Рассмотрим построение кривой титрования на примере комплексонометрического титрования катионов металлов, (титруемое вещество X) стандартным раствором ЭДТА (титрант Т) в сильно щелочной среде, когда мольная доля ионов Y4- равна α = 1, т.е. весь незакомплексованный ЭДТА находится в форме анионов Y4-.
Пусть требуется рассчитать и построить кривые комплексонометрического титрования V(Х) = 100 мл = 0,1 л с концентрацией с(Х) = 0,1 моль/л водных щелочных растворов СаСl2 и ZnCl2 раствором ЭДТА с молярной концентрацией с(Т) = 0,1 моль/л при рН = 12.
При титровании протекает реакция образования комплексонатов MY2-:
М2+ + Y4- = MY2-
X T
где М2+ = Ca2+ или Zn2+.
Концентрационная константа устойчивости комплексов β равна:
β = [MY2-]/[M2+][Y4-].
В данном случае концентрационная константа устойчивости комплексов β совпадает с их условной концентрационной константой устойчивости β', поскольку α = 1:
β = αβ'= β'.
1) Расчет рМ = -lg[M2+] исходного раствора. В исходном анализируемом растворе до начала титрования:
рМ = -lg[M2+] = -lgc(X).
2) До точки эквивалентности. В процессе титрования катионы М2+ связываются в прочный комплекс, их концентрация в растворе уменьшается:
|
|
|
[М2+] = [c(X)V(X) – c(T)V(T)]/[V(X) + V(T)];
pM = -lg[M2+]
pM = -lg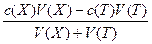
3) Расчет рМ в точке эквивалентности. В ТЭ все катионы М2+ оттитрованы с образованием комплекса MY2-. Небольшая часть комплекса диссоциирует по схеме:
MY2- = М2+ + Y4-
Тогда рМ = [pc(X) + lgβ]/2
pM = 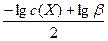
4) Расчет рМ после ТЭ: в растворе присутствует избыток анионов [Y4-]
pM = pc(X) + lgβ + lg[Y4-]]
pM = -lgc(X) + lgβ + lg[Y4-]].
Кривые титрования. На рисунке показаны рассчитанные кривые комплексонометрического титрования катионов кальция и цинка раствором ЭДТА. Значения рМ в ТЭ равны pCa = 5,80,pZn = 8,65.. Скачки на кривых титрования ∆pCa ≈ 8- 4 = 4. ∆pZn ≈ 14- 4.
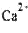

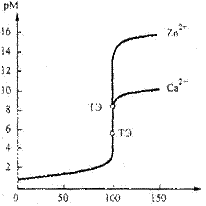 V(T), мл
V(T), мл
△p(Ca2+) = 4-8
△p(Zn2+) = 4-14
Рассчитанные кривые комплек-сонометрического титрования 100 мл растворов, содержащих катионы Са2+ или Zn2+ при концентрации 0,1 моль/л, стандартным 0,1 моль/л раствором ЭДТА при рН= 14.
Полученные кривые комплексонометрического титрования позволяют выбрать соответствующий металлохромный индикатор, интервал изменения окраски которого должен укладываться внутрь скачка титрования, т.е. значение показателя индикатора рМ = lgβ(MInd) лежит в интервале скачка ∆рМ на кривой титрования.
Выше расчет точек на кривых комплексонометрического титрования был проведен для таких условий, когда рН = 12 и поэтому α = 1; ЭДТА присутствует только в форме Y4-. В большинстве же реальных случаев комплексономет рическое титрование проводят при меньших значениях рН титруемого раствора, когда в растворе могут присутствовать и другие формы ЭДТА, а не только Y4-. При рН < 11 величина α заметно меньше единицы и равновесные концентрации [Y4-] и [М2+] рассчитывают, используя условные константы устойчивости комплексонатов.
Влияние различных факторов на скачок титрования. Чем больше скачок ∆рМ на кривой комплексонометрического титрования, тем увереннее можно фиксировать КТТ визуальным индикаторным методом. Протяженность скачка титрования зависит от ряда факторов: 1) устойчивости комплексоната, 2) концентрации титруемых катионов металла, 3) значения рН раствора.
|
|
|
1) Чем выше константа устойчивости комплексоната β, тем больше величина скачка титрования. Для малостойких комплексонатов металлов (lg β ≤ 7) скачок на кривой титрования при приемлемых концентрациях реагентов вообще практически отсутствует, так что невозможно подобрать соответствующий индикатор. Поэтому катионы таких металлов (например, щелочных элементов; lgβ ≈ 0,15—2,85) не определяют методом комплексонометрического титрования.
2) Концентрация реагентов (титруемого катиона металла и титранта) также существенно влияет на величину скачка титрования: чем больше концентрация реагентов, тем протяженнее скачок на кривой титрования. При концентрации катионов металла с(М2+) ≤ 10-5 моль/л скачок на кривой титрования практически отсутствует; титрование становится нецелесообразным.
Изменяя значение рН раствора, можно создавать такие условия, когда катионы одних металлов можно титровать комплексонометрически, тогда как катионы других металлов в заданных условиях не титруются и не мешают проведению анализа.
Так, например, при рН ≈ 2 можно комплексонометрически определять железо(III) и цирконий(IV); двухзарядные катионы при этом не титруются (они при рН ≥ 9,5).
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 16295; Нарушение авторских прав?; Мы поможем в написании вашей работы!