
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ковалентная связь. Учение о химической связи – центральный вопрос современной химии
|
|
|
|
Учение о химической связи – центральный вопрос современной химии. Без него нельзя понять причины многообразия химических соединений, механизм их образования, строение и реакционную способность.
Химическая связь и строение молекул
Ядерная реакция
Закон радиоактивного распада. Правило смещения.
Виды радиоактивного излучения
α-отклоняется электрическими и магнитными полями, обладает высокой ионизирующей и малой проникающей способностью.
β- отклоняется электрическими и магнитными полями, обладает малой ионизирующей способностью, а проникающая значительно выше чем у α-излучения. β -излучения – поток быстрых электронов.
γ-неоткланяется электрическое и МП, обладает слабо ионизированностью и высокой проникаемостью. -поток гамма квантов или фотонов.
Радиоактвный распад – естественне радиоактивное превращение ядер, происходит самопроизвольно. Атомное ядро испытывающее распад называется материнским, а возникающее – дочерним.
dN-число ядер распавшихся в интервале времени tдо (t+dt), dN – пропорциональна dtи N.
N-число перераспавшихся ядер в момент времени t.
, -постоянная радиоактивного распада. «-» - общее число радиоактивных ядер уменьшается.
- закон радиоактивного распада, -начальное число не распавшихся ядер в t=0; N-число нераспавшихся ядер в момент t.
Период полураспада- время за которое исходное число радиоактивных ядер уменьшится в двое.
Среднее определение жизни радиоактивного ядра:
Активность нуклида А-число распадов происходящих с ядром образца в одну секунду.
Нуклид- общее название атомных ядер, которые отличаются числом протонов и нейтронов.
Бк (Биккерелли), 1к (кюри)=3,7*1010Бк
|
|
|
Радиоактивный распад происходит в соответствии с правилами смещения:
1. α-распад
2. β-распад:
a) β-(электронный распад), -антинейтрино-имеет положительный заряд спин= имассу покоя =0.β-распад сопровождается испусканием гамма-лучей.
b) β-распад (позитронный распад), -нейтрино.
c) Электронный захват
3. γ-распад- неявляется самостоятельным сопровождает α и β –распады. При γ-излучении А и z неизменяются- неописываются правилами смещения.
Образование молекул из атомов приводит к выигрышу энергии, так как в обычных условиях молекулярное состояние устойчивее, чем атомное. Учение о строении атомов объясняет механизм образования молекул, а также природу химической связи.
У атома на внешнем энергетическом уровне может содержаться от одного до восьми электронов. Если число электронов на внешнем уровне атома максимальное, которое он может вместить, то такой уровень называется завершенным. Завершенные уровни характеризуются большой прочностью. Таковы внешние уровни атомов благородных газов: у гелия на внешнем уровне два электрона (s2), у остальных – по восемь электронов (ns2np6). Внешние уровни атомов других элементов незавершенные и в процессе химического взаимодействия они завершаются. Чтобы добиться этого состояния соответствующим атомам приходится разменивать свои электроны. И, как часто случается в жизни, «те, которые имеют меньше, отдают тем, кто имеет больше».
В 1907 г. Н.А. Морозов и позднее в 1916-1918 г.г. американцы Дж. Льюис и И. Ленгмюр ввели представление об образовании химической связи общей электронной парой и предложили обозначать валентные электроны точками
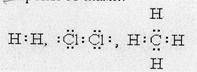
Связь, образованная электронами, принадлежащими двум взаимодействующим атомам, называется ковалентной. По представлениям Морозова-Льюиса-Ленгмюра:
1) при взаимодействии атомов между ними формируются поделенные – общие – электронные пары, принадлежащие обоим атомам;
|
|
|
2) за счет общих электронных пар каждый атом в молекуле приобретает на внешнем энергетическом уровне восемь электронов, s2p6;
3) конфигурация s2 p6 – это устойчивая конфигурация инертного газа и в процессе химического взаимодействия каждый атом стремится ее достигнуть;
4) количество общих электронных пар определяет ковалентность элемента в молекуле и равно оно числу электронов у атома, недостающих до восьми;
5) валентность свободного атома определяется числом неспаренных электронов.
Изображать химические связи принято по разному:
1) с помощью электронов в виде точек, поставленных у химического символа элемента. Тогда образование молекулы водорода можно показать схемой
Н× + Н× ® Н: Н;
2) с помощью квантовых ячеек (орбиталей) как размещение двух электронов с противоположными спинами в одной молекулярной квантовой ячейке
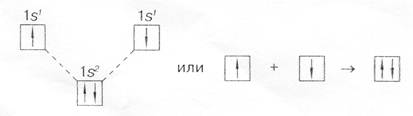
Схема расположения, показывает, что молекулярный энергетический уровень ниже исходных атомных уровней, а значит, молекулярное состояние вещества более устойчиво, чем атомное;
3) часто, особенно в органической химии, ковалентную связь изображают черточкой (например, Н-Н), которая символизирует пару электронов.
Ковалентная связь в молекуле хлора также осуществляется с помощью двух общих электронов, или электронной пары.

Как видно, каждый атом хлора имеет три неподеленные пары и один неспаренный электрон. Образование химической связи происходит за счет неспаренных электронов каждого атома. Неспаренные электроны связываются в общую пару электронов, называемую также поделенной парой.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 360; Нарушение авторских прав?; Мы поможем в написании вашей работы!