
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соединения элементов подгруппы титана
|
|
|
|
Металлические и металлоподобные соединения. Порошки титана, циркония и гафния поглощают водород, кислород и азот. При этом растворенные неметаллы переходят в атомарное состояние и принимают участие в образовании химической связи. Наряду с сильно делокализованной (металлической) возникает локализованная (ковалентная) связь. Благодаря этому система приобретает повышенную твердость и хрупкость. Способность Тi, Zr и Hf поглощать газы используется для получения глубокого вакуума, удаления газов из сплавов и т. д.
Гидриды Тi, Zr и Нf — хрупкие металлоподобные порошки серого или черного цвета. Их идеализированный состав отвечает формуле ЭН2, они являются промежуточными между твердыми растворами и солеподобными (ионными) гидридами типа СаН2.
Разложение гидридов титана, циркония и гафния используется для получения металлов в порошкообразном состоянии и для нанесения металлов на поверхность соответствующих изделий.
Последовательные стадии окисления титана кислородом можно выразить следующей схемой:
Тi + О2 ® Тi – О ® Тi6О ® Тi3О ® ТiО ® Тi2О3 ® ТiО2
твердый раствор
По мере увеличения содержания кислорода доля металлической связи падает, а ковалентной — увеличивается. Тi6О и Тi3О — типичные металлические, а ТiО2 преимущественно ковалентное соединение (DЕ = 3,06 вВ).
Карбиды и нитриды подгруппы титана образуются непосредственным взаимодействием простых веществ при высокой температуре. Соединения ЭN и ЭС (переменного состава) — кристаллические вещества, очень твердые, тугоплавкие (3000—4000 °С), хорошо проводят электрический ток и химически инертны. Аналогичными свойствами обладают силициды ЭSi2, бориды ЭВ, ЭВ2. Все они, конечно, обладают переменным составом. Соединения ТiС, ТiN, ТiО, ZrС, НfC имеют структуру типа NаСl и друг с другом образуют твердые растворы.
|
|
|
Ценные физико-химические свойства металлоподобных соединений элементов подгруппы титана определяют их большое значение для техники. Например, сплав состава 20% НfС и 80% ТiС один из самых тугоплавких (Tпл. 4400 °С).
Характер взаимодействия титана и его аналогов с металлами зависит от положения последних в периодической системе, Так, с близкими к нему по свойствам хромом и ванадием титан образует непрерывный ряд твердых -растворов замещения:
 В ряду Мn—Fе—Со—Ni возможность образования твердых растворов с титаном уменьшается и, наоборот, усиливается склонность к образованию интерметаллических соединений. Так, при сплавлении титан весьма энергично взаимодействует с железом, образуя Fе3Тi и FеТi. Аналогично ведут себя Со, Ni, Сr и Zn, образующие с титаном соединения типа М3Тi и МТi.
В ряду Мn—Fе—Со—Ni возможность образования твердых растворов с титаном уменьшается и, наоборот, усиливается склонность к образованию интерметаллических соединений. Так, при сплавлении титан весьма энергично взаимодействует с железом, образуя Fе3Тi и FеТi. Аналогично ведут себя Со, Ni, Сr и Zn, образующие с титаном соединения типа М3Тi и МТi.
Соединения Тi (IV), Zr (IV), Hf (IV). Для титана и его аналогов известны тетрагалогениды ЭНаl4, диоксиды ЭO2, дисульфиды ЭS2, дисульфаты Э(SO4)2 и т. п. Кроме того, известны многочисленные производные анионных комплексов Э (IV) титанаты, цирконаты и гафнаты:
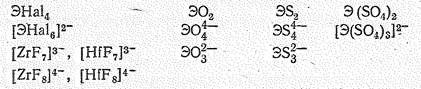 Для титана (IV) наиболее характерно координационное число 6 и реже 4. Цирконий (IV) и гафний (IV), кроме того, проявляют координационные числа 7 и 8.
Для титана (IV) наиболее характерно координационное число 6 и реже 4. Цирконий (IV) и гафний (IV), кроме того, проявляют координационные числа 7 и 8.
Диоксиды ЭО2 имеют координационные кристаллические решетки. В одной из модификаций ТiО2 — рутиле — координационное число титана 6, в кристаллах ZrО2 и НfO2 координационные числа Zr и Нf достигают 7 и 8.
 Диоксиды ЭО2 – тугоплавкие белые вещества с высокими энтальпиями и энергиями Гиббса образования:
Диоксиды ЭО2 – тугоплавкие белые вещества с высокими энтальпиями и энергиями Гиббса образования:
Химически они довольно инертны. В воде, холодных разбавленных кислотах (кроме НЕ) и щелочах не растворяются. Лишь при длительном нагревании ЭО2 медленно взаимодействуют с кислотами, а при сплавлении — со щелочами. Из диоксидов наиболее широкое применение находит ТiО2. Вследствие химической инертности ТiO2 используется в качестве наполнителя в производстве пластмасс, красок, резины, а ZrО2 — для изготовления огнеупорных тиглей и плит.
|
|
|
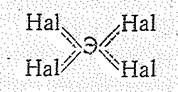 Из тетрагалогенидов ЭНаl4 хлориды, бромиды и иодиды в твердом состоянии имеют молекулярные решетки. Устойчивость тетраэдрических молекул ЭНаl4 обусловливается p-связями, образованными за счет свободных орбиталей атомов Э и неподеленных электронных пар атомов галогенов:
Из тетрагалогенидов ЭНаl4 хлориды, бромиды и иодиды в твердом состоянии имеют молекулярные решетки. Устойчивость тетраэдрических молекул ЭНаl4 обусловливается p-связями, образованными за счет свободных орбиталей атомов Э и неподеленных электронных пар атомов галогенов:
Это отвечает следующей электронной конфигурации [sсв]8[pсв]10[p]6. Поэтому в частности, эффективный заряд атома титана в TiCl4 (dTi = 0,25) ниже, чем атома углерода в ССl4 (dC= 0,3).
Тетрафториды полимерны. Так, кристаллы ТiF4 образованы из октаэдров ТiF6 структурной единицей ZrF4 и НfF4 является восьмивершинник ЭЕ6— квадратная антипризма.
Почти все галогениды (кроме ТIВr4 и ЭI4) бесцветны. В обычных условиях, за исключением жидкого ТiСl4, тетрагалоген иды — твердые вещества, В ряду ТIНаl4— ZrНаl4—НfНаl4 температура плавления однотипных галогенидов возрастает. Например, ТiСl4 — жидкость (Tпл. —23°С), а ZrСl4 и НfСl4 плавятся (под давлением) примерно при 430 °С.
Галогениды Э (IV) обычно получают накаливанием ЭО2 с углем в атмосфере галогена:
ЭО2 + 2С + 2Сl2 = ЭСl4 + 2СО
Тетрагалогениды молекулярной структуры летучи, химически активны. Например, они склонны к присоединению донорных молекул, легко гидролизуются. Из них наиболее широко используется ТiСl4 в основном для получения металлического титана. Иодиды Э (IV) при высоких температурах (1000—1400° С) распадаются на под и металл,. что используется, как указывалось, для получения особо чистых Тi, Zr и Нf.
Гидроксиды Э (IV) — студенистые осадки переменного состава ЭO2×nН2О. Свежеполученные осадки (a-форма) имеют относительно большое число ОН-групп. Поэтому они более реакционноспособны (растворимы в кислотах), чем состарившиеся осадки (b-форма), в которых оловые группы замещены на оксоловые. Гидроксид титана (IV) растворим в концентрированных щелочах, гидроксиды циркония (IV) и гафния (VI) с щелочами практически не взаимодействуют.
Гидратированные ионы Тi4+, Zr4+ и Нf4+ вследствие большого заряда в растворах существовать не могут. Поэтому их растворимые производные сильно -гидролизуются. Гидролиз протекает с образованием разнообразных многоядерных комплексов. Как первую стадию гидролиза ТIСl4 можно рассматривать его координационное насыщение до ТiСl4×2Н2O с последующим отщеплением молекул НCl:
|
|
|
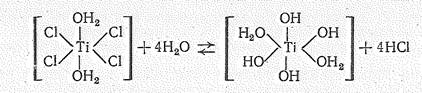
На последующих же стадиях гидролиза образуются полимерные оловые и оксоловые комплексы:
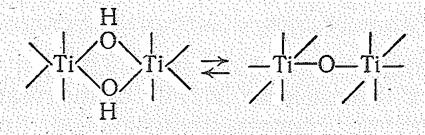
Переход оловых комплексов в оксоловые протекает легче, чем обратное превращение. Переходу гидроксоаквокомплексов в оловые и оксоловые соединения способствуют повышение температуры, щелочная среда и длительное стояние раствора. При этом возможна дальнейшая полимеризация, вследствие чего полиядерные комплексы разрастаются до размеров коллоидных частиц; возможно даже выделение свободных гидроксидов (ЭО2×nН2О).
В многоядерных комплексах молекулы воды и ОН-группы, могут замещаться на имеющиеся в растворе анионы. Все это объясняет причину сложного состава соединений, образующихся при химических реакциях в водных растворах. Так, при взаимодействии оксидов или гидроксидов с кислотами образуются не средние соли, а соответствующие оксо и гидроксопроизводные, например типа ЭОХ2 (где Х = Сl-, Вr-, I-, NO3-, 1/2SO4):
Тi(ОН)4 + 2НСl = ТiOСl2 + Н2O
ТiO2 + Н2SO4 = ТiOSO4 + Н2O
Из кислых растворов выделяются кристаллогидраты ТiОСl2×2Н2O, ТiОSО4×2Н2O, ZrOСl2×8Н2O, ZrОSO4×8Н2O, НfOСl2×8Н2О.
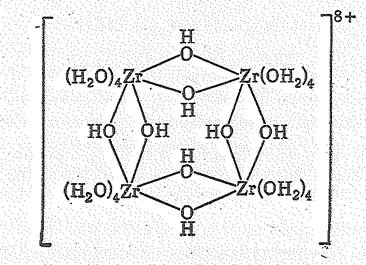 Кристаллы ТiОSО4×2Н2O содержат бесконечные цепи —Тi—О—Тi—О—, которые связываются радикалами SО42-. Выделяемый из слабокислого раствора ZrОСl2×8Н2O содержит тетрамерный ион [Zr4(ОН)8(ОН2)16]8+:
Кристаллы ТiОSО4×2Н2O содержат бесконечные цепи —Тi—О—Тi—О—, которые связываются радикалами SО42-. Выделяемый из слабокислого раствора ZrОСl2×8Н2O содержит тетрамерный ион [Zr4(ОН)8(ОН2)16]8+:
Здесь атомы Zr имеют координационное число 8 и связаны посредством ОН-мостиков; каждый атом окружен еще четырьмя молекулами Н2О. Атомы О молекул Н2O и ОН-групп расположены в вершинах квадратной антипризмы.
Соединения простого состава получают лишь в неводных растворах. Так, Тi(SO4)2 образуется при взаимодействии ТiСl4 и SО3 в жидком хлористом сульфуриле (SO2Cl2) или сплавлением ТiO2 с дисульфатом:
ТiСl4 + 4SO3 = Тi(SO4)2 + 2SO2Сl2
ТiO2 + 2К2S2O7 = Тi(SO4)2 + 2К2SO4
а Zr(NО3)4— взаимодействием безводных ZrСl4 и N2O5.
Из анионных комплексов Э (IV) относительно более просты по составу и структуре галогенопроизводные. Наиболее устойчивы в растворах и легко образуются фторокомплексы.
|
|
|
Так, ЭО2 легко растворяются в плавиковой кислоте, а ЭF4 — так же и в растворе фторидов s -элементов I группы:
6НF + ЭO2 = Н2[ЭF6] + 2Н2O
2KF + ЭF4 = К2[ЭF6]
Ион ZrF62- — многоядерный комплекс, образованный восьмивершинниками ZrF6, объединенными ребрами. Одновременно образуются фтороцирконаты и фторогафнаты типа M3+1[ZrF7] и М4+1[ZrF8]. Фторотитанаты, фтороцирконаты и фторогафнаты s -элементов I группы хорошо растворимы в воде.
Производные других анионных комплексов Э (IV) обычно образуются сплавлением соответствующих соединений, например:
2КСl + ЭСl4 = К2ЭСl6
2КОН + ЭО2 = К2ЭО3 + Н2O
СаСО3 + ТiO2 = СаТiО3 + СО2
Состав оксотитанатов (IV), оксоцирконатов (IV) и оксогафнатов (IV) весьма разнообразен. Простейшие из них отвечают формулам М+2ЭO3, М2+1ЭO3 и М2+2ЭO4. Структура оксотитанатов часто соответствует структурному типу перовскита СаТiО3 и ильменита FеТiO3. Большинство оксотитанатов, оксоцирконатов и оксогафнатов представляют собой смешанные оксиды, в воде они не растворяются, производные щелочных металлов гидролизуются.
Для титана и его аналогов весьма характерны анионные комплексы, в которых роль лиганда играет пероксид-радикал О22-. Пероксотитанаты и пероксоцирконаты образуются при действии Н2О2 на соответствующие соединения, например:
Э(SO4)2 + Н2O2 = Н2[Э(О2) (SO4)2]
При этом растворы соединений Тi (IV) приобретают желто-оранжевую окраску. На этом основан один из аналитических методов обнаружения соединений Тi (IV) и пероксида водорода.
Соединения Тi (III). Как указывалось, степень окисления +3 отчетливо проявляется лишь у титана. Производные Тi (III) получают восстановлением соединений Тi (IV), например: 1200 oC
2ТiО2 + Н2 === Тi2О3 + Н2O
650 oC
2ТIСl4 + Н2 === 2Т1Сl3 + 2НСl
При электрохимическом или химическом восстановлении соединений Тi (IV) в водных растворах образуется фиолетовый аквокомплекс Тi(OН2)63+.
Устойчивое координационное число Тi (III) равно 6; его октаэдрические комплексы имеют электронную конфигурацию
[sсв]12[pd]1.
Переход pd-электрона на молекулярную sdразр-орбиталь определяет окраску комплексов. Для соединений Тi (III) это обычно (при D = 2,1 — 2,5 эВ) отвечает фиолетовой окраске.
В соответствии с устойчивым координационным числом Тi (III) его оксид Тi2O3 (фиолетовый) имеет структуру типа a-Аl2O3; хлорид ТiСl (фиолетовый) — слоистую структуру; в кислых растворах существует аквокомплекс [Тi(ОН2)6]3+, который входит в состав ряда кристаллогидратов и титановых квасцов M+1Тi(SO4)2×12Н2O, придавая им фиолетовую окраску.
В воде Тi2О3 практически не растворяется. Грязно-фиолетовый осадок Тi2О3×nН2О,получаемый при добавлении щелочи в растворы солей Тi (III), является основным; в избытке щелочи не растворяется.
Производные Тi (III) восстановители. Например, они легко окисляются кислородом воздуха:
4ТiСl3 + О2 + 2Н2O = 4ТiОСl2 + 4НСl
Окисление соединений Тi (III) в кислых растворах сопровождаегся исчезновением фиолетовой окраски за счет образования соединений Тi (IV). Для соединений Тi (III) возможны также реакции диспропорционирования. Так, при нагревании до 400 °С ТiСl распадается по уравнению
+3 +2 +4
2ТiСl3 (т) = ТiСl2 (т) + ТiСl4 (г)
Легко показать, что эта реакция эндотермична (DНo298 = 142 кДж/моль), но сопровождается большим возрастанием энтропии (DSo298 = 171 Дж/(град×моль), поскольку один из продуктов — газ. При дальнейшем нагревании ТiСl2 также диспропорционирует:
2Тi+2Сl2 (т) = Тi0 (т) + Тi+4Сl4 (г)
Хотя эта реакция еще более эндотермична (DНo298 = 274 кДж/моль), возрастание энтропии на 155 Дж(град. моль) обеспечивает протекание процесса, но уже при более высокой температуре.
соединения Zr (III) и Нf (III) подробно не изучены.
d-ЭЛЕМЕНТЫ VB ГРУППЫ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
 d-Элементы V группы — ванадий V, ниобий Nb, тантал Та и дубний Db входят в подгруппу ванадия:
d-Элементы V группы — ванадий V, ниобий Nb, тантал Та и дубний Db входят в подгруппу ванадия:
В отличие от подгруппы мышьяка в подгруппе ванадия по мере увеличения порядкового номера элемента уплотняются электронные оболочки атомов. Об этом свидетельствуют рост в ряду V—Nb—Tа первой энергии ионизации и характер изменения атомных и ионных радиусов. Вследствие лантаноидного сжатия атомные и ионные радиусы Nb и Та практически одинаковы, поэтому ниобий и тантал по свойствам ближе друг к другу, чем к ванадию.
Ванадий в соединениях имеет степени окисления +2, +3, +4 и +5. для ниобия и тантала, как и у других 4 d - и 5 d -элементов, наиболее устойчива высшая степень окисления, т. е. +5. Высшая степень окисления ванадия стабилизируется в фторо- и оксопроизводных.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2686; Нарушение авторских прав?; Мы поможем в написании вашей работы!