
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гульдберг и Вааге 1867, 1879
|
|
|
|
Пример: 
pV = nRT
p =  = cRT
= cRT
Для реакции в газовой фазе υ = K P * P
* P
Для сложных реакций (протекающих в несколько стадий) закон действующих масс не выполняется.
Основной  постулат формальной кинетики
постулат формальной кинетики
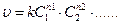
Скорость реакции прямопропорциональна произведению концентрации исходных веществ, взятых в степенях в общем случае не равных стехиометрическим коэффициентам.
n1, n2… - частные порядки реакции по веществам.
Частным порядком по веществу называется показатель степени при концентрации данного вещества в кинетическом уравнении
n = n1 + n2 + … - общий порядок реакции.
Порядок может зависеть от механизма, он не должен зависеть от температуры, концентрации исходных веществ.
k - константа скорости реакции, она численно равна скорости при концентрациях равных 1, поэтому ее иногда называют удельной, она зависит от тех же факторов что и скорость, кроме концентрации.
Размерность зависит от порядка реакции [ K ] = 
Пример: 4HBr + O 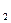 = 2Br
= 2Br 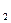 + 2H
+ 2H 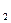 O
O
υ = K*C  * C
* C 
Возможен следующий механизм реакции
 HBr + O
HBr + O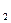 = HOOBr
= HOOBr
HOOBr + HBr = HOBr + HOBr
HOBr + HBr = Br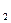 + H
+ H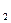 O
O
HOBr + HBr = Br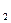 + H
+ H O
O
Механизм реакции – совокупность элементарных стадий приводящих к появлению продуктов реакции.
Из опыта: υ = K*C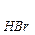 * C
* C
Кинетическая классификация реакции
1) по молекулярности
Молекулярность реакции определяется количеством молекул одновременно участвующих в элементарном акте химического превращения (применяется только для простых реакций).
Различают одно, двух и трехмолекулярные, более трех не встречается, так как одновременное столкновение более трех и более маловероятно.
2) по порядку реакции
Различают реакции I, II, III, нулевого, дробного и отрицательного порядка. Порядок – величина формальная, может быть любым, но практически больше четырех не встречается.
|
|
|
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 476; Нарушение авторских прав?; Мы поможем в написании вашей работы!