
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метод МО ЛКАО
|
|
|
|
Згідно з методом молекулярних орбіталей (МО) МО ЛКАО (молекулярні орбіталі як лінійна комбінація атомних орбіталей) хімічний зв’язок виникає при перекриванні атомних орбіталей. Відмінність МО від АО полягає в тому, що електронні хмари оточують ядра вже не одного атома, а ядра двох і більшої кількості атомів. Метод МО розглядає молекулу, як єдину систему, в якій електрон рухається в полі дії всіх інших ядер і електронів. Метод МО поширює квантово-хімічні закономірності для атомів на складнішу систему - молекулу. У методі МО всі електрони в молекулі знаходяться не на атомних, а на молекулярних орбіталях, відповідно з принципом Паулі та правилом Гунда.
Розглянемо утворення молекули гідрогену на основі метода МО ЛКАО.
При утворенні локалізованого зв’язку між двома атомами гідрогену кількість АО, які перекриваються (вступають в лінійну комбінацію), дорівнює двом. Внаслідок лінійної комбінації замість двох вихідних АО з хвильовими функціями y1 і y2 виникають дві МО з хвильовими функціями j і j *. Вони в загальному вигляді являють собою алгебраїчну суму хвильових функцій вихідних АО, помножених на відповідні вагові коефіціенти с1-с4, які вказують на частки АО в МО:
j = с 1y1 + с2y2 ; j * = с3y1 - с4y2
В випадку утворення молекули гідрогену с 1 = с2, а с3 = с4. Тоді
jН-Н = с 1y1 + с1y2 ; j * Н-Н = с3y1 - с3y2
Оскільки атомні орбіталі є похідними квадратів хвильових функцій y, то молекулярні орбіталі є похідними квадратів хвильових функцій j і j *:
j 2 = (с1y1 + с2y2)2 = с12y1 2 + 2с1 с2y1 y2 + с22y2 2; (1)
(j *)2 = (с3y1 - с4y2)2 = с32y1 2 – 2с3 с4y1 y2 + с42y2 2 (2)
Для молекули гідрогену значення j 2 і (j *)2 набувають вигляду:
j 2 Н-Н = (с1y1 + с1y2)2 = с12y1 2 + 2с1 2y1 y2 + с12y2 2; (3)
(j * Н-Н)2 = (с3y1 - с3y2)2 = с32y1 2 – 2с32y1 y2 + с32y2 2 (4)
|
|
|
Вирази 3, 4 в наближенні с1 =с3 = с відрізняються від простої суми двох атомних орбіталей, тобто від виразу (y12+ y22) на величину 2с2y1 y2. Позитивне значення 2с2y1 y2 відповідає додатковому зростанню хвильової функції (електронної густини) в області між ядрами, що збільшує притягання між електронами і ядрами і, таким чином, знижує енергію системи нижче рівня, який відповідає двом ізольованим атомам з розподілом електронів y12+ y22 . Відповідно, знаходження електронів на орбіталі j сприяє утворенню зв’язку між атомами і така МО називається зв’язуючою орбіталлю. Негативне значення 2с2y1y2 відповідає зменшенню електронної густини в області між ядрами, що збільшує відштовхування між ядрами і, таким чином, збільшує енергію системи вище рівня енергії вихідних ізольованих атомів; відповідно, заповнення електронами орбіталі j * перешкоджає утворенню зв’язку між атомами. Така МО називається розпушуючою орбіталлю.
Таким чином, при утворенні локалізованого зв’язку між двома атомами при перекриванні двох АО утворюються дві МО, одна з яких має нижчу енергію, ніж кожна з вихідних АО і називається зв’язуючою МО, а друга має вищу енергію, ніж кожна з вихідних АО, і називається розпушуючою МО. Відповідно, утворення локалізованого зв’язку виглядає як перехід двох електронів з протилежними спінами з атомних орбіталей на зв’язуючу МО більш низької енергії:
а)
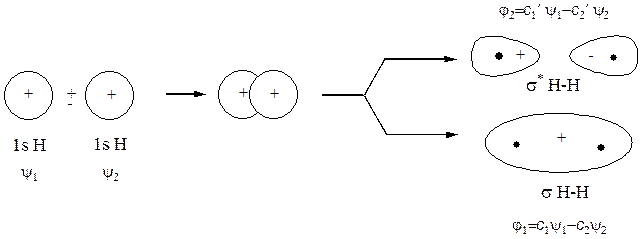 б)
б)
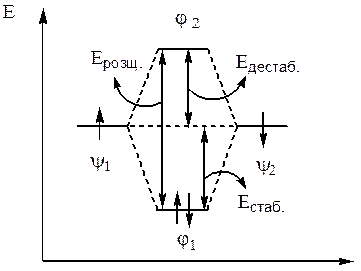
Рис.10 Схема взаємодії АО двох атомів гідрогену з утворенням зв’язуючої та розпушуючої МО (а) і енергетична діаграма утворення молекули гідрогену (б)
Крім зв’язуючих і розпушуючих МО можливе утворення також незв’язуючих МО, на яких розміщуються неподілені пари електронів (наприклад, вільна пара електронів в молекулі аміаку).
При утворенні молекули HНe+ єдиний електрон катіона гелію знаходиться на АО 1s, як і електрон атома гідрогену. Крім більшого ядерного заряду катіон гелію повністю аналогічний атому гідрогену. При зближенні катіона гелію з атомом гідрогену 1s-АО можуть взаємодіяти і утворювати дві МО – одну зв’язуючу і одну розпушуючу, як і в випадку утворення молекули гідрогену. Таким чином, гідроген і катіон гелію сполучаються і утворюють молекулу HНe+.
|
|
|
Однак в цьому випадку іонізаційний потенціал катіону Нe+ (54,14 еВ) значно більший за іонізаційний потенціал атома H (13,53 еВ); тому 1s-АО катіону гелію знаходиться значно нижче за рівнем енергії, ніж 1s-АО атома гідрогену. Так як в катіоні Нe+ електрон зв’язаний сильніше, ніж в атомі H, не можна сподіватись, що парою електронів зв’язку H-Нe+ однаково володіють обидва атоми. Дійсно, зв’язуюча МО в молекулі HНe+ дуже асиметрична і електрони, які знаходяться на ній, проводять значно більше часу поблизу ядра гелію, ніж поблизу протона. Ця МО дуже мало відрізняється від 1s-АО самого атома гелію, тому її енергія також дуже близька до енергії цієї орбіталі, а зміна енергії при зв’язувані атома H і катіона Нe+ є незначною. Оскільки більша частина АО гелію використана для утворення зв’язуючої МО, то розпушуюча МО подібна до іншої АО, тобто АО атома гідрогену.
Взагалі, об’єми АО, які вступають в лінійну комбінацію, перерозподіляються в МО, які утворюються, без змін вихідних об’ємів АО. Виконання цієї умови є можливим, якщо коефіціенти с в виразах 1, 2 нормовані, тобто:
с12 + с32 = 1, с22 + с42 = 1.
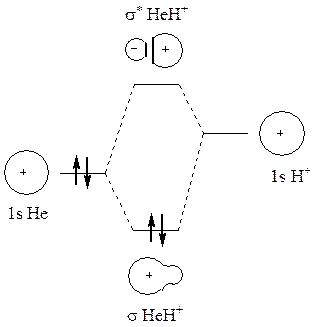
Рис.11 Схема взаємодії АО атома гідрогену з іоном Нe+ з утворенням зв’язую-чої та розпушуючої МО і енергетична діаграма утворення молекули HНe+
Базуючись на викладеному, розглянемо основні правила взаємодії між атомними орбіталями:
1. В лінійну комбінацію можуть вступати лише АО орбіталі однакової симетрії відносно осі (площини), яка з’єднує атоми, що взаємодіють.
2. Число орбіталей, які утворюються при лінійній комбінації, завжди дорівнює числу орбіталей, які вступають в лінійну комбінацію.
3. Зв’язуючі МО утворюються при перекриванні хвильових функцій з однаковими знаками (y1 + y2), розпушуючі – при перекриванні хвильових функцій з протилежними знаками (y1 - y2).
4. Зв’язуюча МО утворюється за рахунок домішування до орбіталі з меншою енергією орбіталі з більшою енергією; ця орбіталь більш подібна до вихідної орбіталі з меншою енергією. Розпушуюча МО утворюється за рахунок домішування до орбіталі з більшою енергією орбіталі з меншою енергією; ця орбіталь більш подібна до вихідної орбіталі з більшою енергією.
|
|
|
5. Суттєво взаємодіють лише ті орбіталі, що перекриваються.
6. Сильно взаємодіють лише ті орбіталі, які близькі за енергіями.
7. Енергія дестабілізації (енергія, на яку збільшується енергія розпушуючої МО порівняно з енергією вихідних орбіталей) завжди трохи більша за енергію стабілізації (енергію, на яку зменшується енергія зв’язуючої МО, порівняно з енергією вихідних орбіталей). Тому заповнення електронами розпушуючої МО завжди приводить до розриву відповідного зв’язку.
8. Енергія розщеплення МО, які утворюються (різниця енергій розпушуючої та зв’язуючої МО) тим більша, чим більше інтеграл перекривання взаємодіючих орбіталей.
9. Інтеграл перекривання зростає із збільшенням напрямленості орбіталей в просторі (наприклад, перекривання напрямлених гібридних орбіталей завжди більше, ніж s -орбіталей), із зменшенням енергетичної щілини між ними (різниці між енергіями вихідних орбіталей) та із зближенням орбіталей за розміром (наприклад, р- орбіталі однієї оболонки завжди перекриваються сильніше, ніж р- орбіталі різних оболонок).
Класифікація органічних реакцій
Існують різні способи класифікації органічних реакцій:
– за типами хімічних перетворень;
– за типами розриву зв’язку;
– за типами реагентів.
Класифікація органічних реакцій за типами хімічних перетворень зв’язків
1. Реакції дисоціації та рекомбінації: А-В ® А+ + В-(А∙+В∙), наприклад:
HCºCH ® HCºC- + H+ або HCºCH ® HCºC· + H·
2. Реакції заміщення S (від Substitution): А-В + С-D ® AD + BC, наприклад:
HCºCH + NaOCl ® HCºCCl + NaOH
3. Реакції приєднання А (від Addition): А + В ® АВ, наприклад:
HCºCH + HCl ® H2C=CHCl
4. Реакції відщеплення Е (від Elimination): АВ ® А¢ + В¢, наприклад:
ClCH2CH2Cl + Zn ® CH2=CH2 + ZnCl2
5. Реакції ізомеризації (Isomerisation) та перегрупування (Rearangement), наприклад:
CH2=CH-СH2CH3 ® CH3CH=CHCH3
CH3O-CºN ® CH3N=C=O
|
|
|
6.  Реакції циклоприєднання (Сycloaddition), наприклад:
Реакції циклоприєднання (Сycloaddition), наприклад:
СН2=СН2 + СН2=СН2 ®
7. Реакції окиснення (Oxygenation) та відновлення (Reduction), наприклад:
CH4 + [O] ® CH3OH та CH3CH=O + 2H ® CH3CH2OH
Вказані типи реакцій можуть здійснюватись із збереженням числа атомів С в ланцюгу або із зміною їх числа – скорочення ланцюга, збільшення ланцюга, утворення циклу з нециклічних сполук, утворення нециклічних сполук із циклічних сполук, зміною розмірів циклу.
Класифікація органічних реакцій за типами розриву зв’язку
За типами розриву зв’язку всі реакції поділяються на гомолітичні та гетеролітичні.
При гомолітичному розриві зв’язку (гомолізі) утворюються фрагменти, кожний з яких має по одному електрону, тобто утворюються вільні радикали. Вільний радикал – це незаряджена проміжна частинка, яка має на одній з орбіталей неспарений електрон.
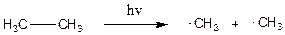
Для радикальних реакцій характерні такі ознаки:
а) реакції прискорюються при опромінюванні світлом, збільшенні температури та наявності сполук, які легко утворюють радикали (ініціаторів радикальних реакцій);
б) реакції уповільнюються при введенні речовин, які легко реагують з радикалами (інгібіторів радикальних реакцій);
в) реакції, як правило, здійснюються у газовій фазі, а також в неполярних апротонних розчинниках;
г) реакції, як правило, є ланцюговими, тобто один ініціатор радикальної реакції теоретично може викликати безмежну кількість перетворень.
При гетеролітичному розриві зв’язку (гетеролізі) обидва електрони зв’язку залишаються на одному з фрагментів, який набуває негативного заряду, тоді як інший фрагмент набуває позитивного заряду і має вільну орбіталь. Аніон - це проміжна частинка, яка має негативний заряд та неподілену пару електронів. Алкіл–аніон має sp3- гібридизацію атома С аніонного центру. Катіон – це проміжна частинка, яка має позитивний заряд та вакантну (порожню, незаповнену) орбіталь. Алкіл-катіон має sp2- гібридизацію атома С катіонного центру.

Для гетеролітичних реакцій характерні такі ознаки:
а) реакції прискорюються в присутності кислот або основ, тобто каталізуються ними;
б) реакції здійснюються в розчинах;
в) акцептори (інгібітори) вільних радикалів не мають впливу на швидкість реакції;
г) швидкість реакції критичним чином залежить від типу розчинника;
д) реакції, як правило, є моно- та бімолекулярними. Кожна реакція складається з елементарних акцій або стадій, які відбуваються в певній послідовності. Якщо в елементарній реакції (стадії) бере участь одна молекула або частинка реакція називається мономолекулярною, якщо ж дві молекули або частинки – бімолекулярною. Молекулярність визначається тільки для окремих стадій реакції.
е) з кінетичної точки зору реакції бувають, як правило, 1-го та 2-го порядків. Порядком реакції називається сумарний показник ступенів концентрації реагуючих компонентів в рівнянні, яке визначає загальну швидкість реакції. Як правило, якщо швидкість реакції залежить від концентрації одного реагенту, ми маємо реакцію 1-го порядку, якщо ж швидкість реакції залежить від концентрації двох реагентів – реакцію 2-го порядку.
Класифікація органічних реакцій за типами реагентів
При розгляді механізмів реакцій для зручності користуються такими поняттями як субстрат (реагуюча молекула або реактант) та атакуючий реагент. Хоча такий розподіл є певною мірою умовним, субстратом, як правило, виступає молекула, яка постачає атом карбону для утворення нового зв’язку.
Всі реагенти поділяються на радикальні, нуклеофільні та електрофільні. В гомолітичних реакціях беруть участь вільні радикали, в гетеролітичних реакціях – нуклеофіли та електрофіли. Відповідно, всі реакції за типами реагентів поділяються на радикальні, нуклеофільні та електрофільні.
Нуклеофільні реакції – це реакції, в яких реагентами виступають нуклеофіли "ті, що люблять ядро" – частинки або молекули з електронодонорними властивостями. Вони мають хоча б одну неподілену пару електронів і віддають її для утворення ковалентного зв’язку атому, з яким вони вступають в реакцію. За природою елементів, які несуть на собі вільну пару електронів, розрізняють С-нуклеофіли (наприклад, СН3-), N-нуклеофіли (NH3), О-нуклеофіли (H2O), S-нуклеофіли (HS-), тощо. Умовно всі нуклеофіли поділяють на три групи: 1) аніони: HO-, I-, RS-, RO-, R3C- , тощо; 2) сполуки з вільними парами електронів: H2O, ROH, NH3, RSH, тощо; 3) ненасичені сполуки з p-електронами: алкени, алкіни, дієни, арени.
Частинка або молекула, яка залишає субстрат після його взаємодії з нуклеофілом і забирає з собою електронну пару, називається нуклеофугом.
Нуклеофільні реакції позначаються символом N.
Електрофільні реакції – це реакції, в яких реагентами виступають електрофіли "ті, що люблять електрони" – частинки або молекули з електроакцепторними властивостями, які здатні утворювати ковалентний зв’язок за допомогою своєї вакантної орбіталі або внаслідок високої спорідненості до електрона. За природою елементів, які відповідають за акцепторні властивості, розрізняють Н-електрофіли (наприклад, протони кислот), В-електрофіли (BF3), N-електрофіли (солі діазонія), S-електрофіли (SО3) і т.д. Всі електрофіли умовно поділяють на три групи: 1) катіони: H+, Cl+, O2N+, R3C +, тощо; 2) сполуки з вакантними орбіталями: AlCl3, FeBr3, BF3- кислоти Льюіса, SO3, тощо; 3) сполуки з полярними зв’язками, в яких на атомі С існують ефективні часткові позитивні заряди: нітрили RCºN, карбонілвмісні сполуки RCX=O, тощо.
Частинка або молекула, яка залишає субстрат після його взаємодії з електрофілом і відходить без електронної пари, називається електрофугом.
Електрофільні реакції позначаються символом E.
Проміжні частинки в органічних реакціях. Взаємний вплив атомів молекулах
Загальні правила для проміжних частинок.
1. Проміжні частинки (радикали, катіони, аніони) утворюються при гомолізі або гетеролізі найслабкіших зв’язків у молекулі з утворенням найбільш стійких частинок.
2. Всі проміжні частинки високо реакційноздатні і мають дуже малий час життя.
3. Реакційна здатність проміжних частинок зменшується із збільшенням їх стійкості.
4.Стійкість проміжних частинок обернено пропорційна величині заряду або частці неспареного електрона, локалізованих відповідно на іонних або радикальних центрах частинок. Тобто із збільшенням заряду на іонному центрі або частки неспареного електрона на радикальному центрі стійкість частинки зменшується (вона важче утворюється).
5. Стійкість проміжної частинки зростає із збільшенням делокалізації заряду або неспаренного електрона по ній. Стійкість проміжних частинок залежить від прояву електронних ефектів, перерахованих далі в порядку зменшення їх впливу на делокалізацію заряду або неспаренного електрону -ефект супряження (кон’югації), ефект надсупряження та індукційний ефект.
В молекулах органічних речовин під впливом наявних в них різних за своєю природою атомів або груп атомів відбувається перерозподіл електронної густини хімічних зв’язків. Якщо молекула побудована з різних за електронегативністю атомів відбувається зміщення електронної густини в бік атома або групи атомів з більшою електронегативністю. Наприклад, в молекулі CH3-Cl атом Cl, як більш електронегативний, викликає зміщення електронної густини на себе. s-Зв’язок C-Cl стає полярним, на атомі Cl виникає частковий негативний заряд, на атомі С - частковий позитивний заряд. Здатність певної групи атомів або окремого атома викликати зміщення електронної густини вздовж s-зв’язків за рахунок електростатичної індукції називається індукційним ефектом.
Індукційний ефект - це зміщення електронів s-зв’язку в напрямку більш електронегативного атома. При цьому, якщо атом або група атомів відштовхують від себе електронну густину, то такий індукційний ефект називають позитивним і позначають як + I- ефект; якщо ж атом або група атомів притягують електронну густину сусідніх зв’язків на себе, то такий індукційний ефект називають негативним і позначають як –I -ефект.
+I- Ефект виявляють:
а) алкільні групи, причому + I- ефект збільшується з зростанням кількості атомів С в алкільній групі та розгалудженості алкільної групи в ряду
-CH3 < -CH2CH3 < -CH(CH3)2 < -C(CH3)3;
б) елементи менш електронегативні ніж карбон, наприклад, лужні метали;
в) групи атомів з повним негативним зарядом, при цьому + I- ефект збільшується при зменшенні електронегативності атомів в ряду -О- < -N- < -C-.
Всі ці групи є s-донорами електронів. Всі інші атоми або групи атомів притягують електрони на себе, тобто є s-акцепторами електронів і мають - I -ефект.
- I -Ефект виявляють:
а) елементи більш електронегативні, ніж карбон, наприклад, галогени;
б) групи атомів з повним позитивним зарядом на атомі, сполученому з атомом карбону, наприклад: -С-→О+; -С-→N+; -С-→S+; -С-→Р+.
в) групи атомів з семіполярним зв’язком –C-NO2, а також групи з подвійними зв’язками: -C=O, C=N-R та ін.
г) всі без винятку ненасичені угрупування атомів карбону. При цьому - I -ефект зростає в ряду: ізольований подвійний зв’язок -C=C- < супряжений подвійний зв’язок -C=C-C=C- < кумульований подвійний зв’язок -C=C=C- < потрійний зв’язок -СºС-.
- I -Ефект замісників збільшується із зміщенням елементів зліва направо в періодах і знизу вверх у групах періодичної системи елементів Д.І.Мєндєлєєва, наприклад:
-N < -O- < -F; -Br< -Cl <-F.
Якщо замісник має повний заряд, - I -ефект збільшується із збільшенням електронегативності атома, який несе позитивний заряд:
-О+ > -N+ ; -О+ > -S+ > -Se+.
- I -Ефект залежить також від від гібридизації атома. Наприклад, електро-негативність атома карбону найменша в sp3- гібридному стані, а найвища - в sp -гібридному стані. Відповідно, - I -ефект С-замісників зростає в ряду
С sp3 < С sp2 < < С sp
Оскільки індукційний ефект передається по важко поляризовним s-зв’язкам, він швидко затухає вздовж ланцюга С-С і вже через 3-4 зв’язки майже не проявляється. Індукційний ефект позначають за допомогою стрілок на s-зв’язку в напрямку до більш електронегативного атома: СН3→Cl.
Ефект супряження – це зміщення електронної густини по p-зв’язку в напрямку більш електронегативного атома або групи атомів. Залежно від того, які електрони приймають участь в супряженні розрізняють p-p-супряження, p-p-супряження і навіть s-p- і d-p-супряження. На відміну від індукційного ефекту, при якому відбувається тільки зміна полярності s- або p-зв’язку, при супряженні електронна хмара частково зміщується в область сусіднього зв’язку.
При цьому, якщо атом або група атомів здатні віддавати свої електрони p-зв’язку (тобто виступають в ролі p-донорів електронів), то такий ефект супряження називають позитивним і позначають як + М- ефект; якщо ж атом або група атомів приймають p-електрони від p-зв’язку (тобто виступають в ролі p-акцепторів електронів), то такий ефект супряження називають негативним і позначають як –М -ефект.
+ М -Ефект виявляють атоми або групи атомів, які мають на атомі, безпосередньо сполученому з атомом подвійного зв’язка, щонайменше одну вільну пару електронів: -F, -Cl, -OH, -OCH3,-NH2 і т.д.
+ М -Ефект для елементів, розміщених в середині другого періоду періодичної системи, зменшується із збільшенням заряду ядра атома, який несе вільну пару електронів: -N> -O- > -F. Взагалі, + М -ефект елементів зменшується із зміщенням елементів зліва направо в періодах і зверху вниз у групах періодичної системи елементів, наприклад: -F > -Cl > -Br.
+ М -Ефект виявляють також від’ємно заряджені атоми. Їх ефект більший, ніж ефект тих самих атомів у незарядженому стані, наприклад: -O- > -O-.
- М -Ефект виявляють атоми або групи атомів, які мають на атомі, безпосередньо сполученому з атомом подвійного зв’язка, щонайменше одну вакантну низькорозташовану орбіталь (В, С+) та групи, які мають p-зв’язок між атомами з різною електронегативністю, якщо ця група приєднана менш електронегативним атомом, наприклад: -С=О, -СºN, -С=NH, -NO2. - М -Ефект збільшується із збільшенням електронегативності атома та із збільшенням різниці в електронегативностях атомів, що утворюють дану групу.
Ефект супряження позначається або за допомогою вигнутої стрілки (застаріле), або за допомогою межових структур. Наприклад, в алільному катіоні:
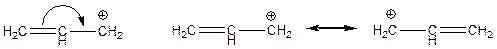
Ефект супряження передається по легко поляризовних p-зв’язках; тому може передаватись на значну відстань вздовж ланцюга С-С майже без затухання.
Ефект супряження має найбільший вплив на на стабілізацію проміжних частинок, тому що при цьому різко (~ в 2 рази) зменшується величина заряду або частка неспареного електрона на окремому атомі за рахунок їх ефективної делокалізації.
Ефект надсупряження – це зміщення електронів s-зв’язків С-Н в напрямку атома з вільною (катіон) або зайнятою одним електроном (радикал) р- орбіталі катіонного або радикального центру, відповідно. Надсупряження відбувається в результаті перекривання орбіталей s-зв’язків С-Н атома карбону, сусіднього з атомом карбону, який має на собі катіонний або радикальний центр.
Ефект надсупряження позначається за допомогою межових структур, наприклад:
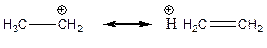
Відносна стійкість проміжних частинок (катіонів, аніонів та радикалів) залежить від прояву вище перерахованих електронних ефектів.
На відносну стійкість карбонієвих катіонів (карб-катіонів) впливають всі три електронних ефекти в порядку зростання: індукційний ефект < ефект надсупряження < ефект супряження. При цьому вплив індукційного ефекту на стабільність карбкатіонів зростає пропорційно числу s-зв’язків атома С катіонного центру з іншими атомами С: первиний < вториний < третиний; вплив ефекту надсупряження зростає пропорційно числу s-зв’язків С-Н на атомах карбону, сусідніх з атомом С катіонного центру. При переході від первиних до вториних і, тим більше, третиних карб-катіонів їх стійкість зростає пропорційно зменшенню позитивного заряду на карб-катіонному центрі внаслідок його часткової делокалізації під впливом прояву + I- ефекта та ефекта надсупряження.
Висока відносна стійкість катіонів алільного і бензильного типів пояснюється домінуючим впливом ефекту супряження внаслідок ефективної делокалізації позитивного заряду по катіону. Так, в алільному катіоні позитивний заряд розсереджений по двох атомах карбону, а в бензильному – по чотирьох атомах карбону.
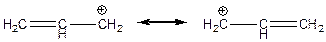
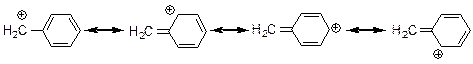
Взагалі, відносна стійкість карбонієвих катіонів під впливом вище розглянутих ефектів збільшується в такому ряду:
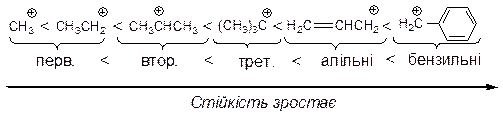
На відносну стійкість радикалів впливають два електронних ефекти в порядку зростання: ефект надсупряження < ефект супряження. Індукційний ефект не впливає на відносну стійкість вільних радикалів, оскільки останні є електрононейтральними. Стійкість радикалів зростає із зменшеням частки неспареного електрона на радикальному центрі в такому ряду:
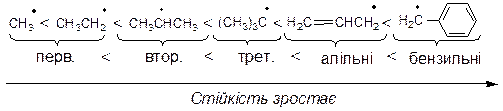
На відносну стійкість карбаніонів впливають два електронних ефекти в порядку зростання: індукційний ефект < ефект супряження. Відносна стійкість карбаніонів зростає із зменшенням негативного заряду на карбаніонному центрі. При переході від метиланіону до інших первиних, а тим більше вториних і третиних карбаніонів стійкість карбаніонів зменшується, внаслідок прояву + I- ефекту алкільних груп, які підвищують негативний заряд на карбаніонному центрі.
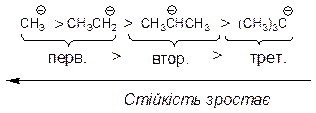
Найбільший вплив на стабілізацію карбаніонів має ефект супряження за рахунок ефективного розсередження негативного заряду по двох атомах карбону.
Ефект надсупряження не має впливу на відносну стійкість карбаніонів.
АЛКАНИ (ПАРАФІНИ)
Алкани або насичені вуглеводні – це такі сполуки карбону з гідрогеном, в молекулах яких кожний атом карбону на з’єднання з любим сусіднім атомом карбону витрачає лише один зв’язок; при цьому всі вільні валентності насичені гідрогеном. Всі атоми карбону знаходяться в sp3-гібридизованому стані.
Насичені вуглеводні утворюють гомологічний ряд з загальною формулою CnH2n+2. Члени гомологічного ряду відрізняються один від іншого на гомологічну різницю (СН2)Х.
Починаючи з бутану вуглеводні: утворюють структурні ізомери – сполуки, які мають одну брутто-формулу, але різну структуру внаслідок різного взаємного з’єднання атомів карбону. Наприклад, бутан та ізобутан. Структурні ізомери мають різні фізичні та хімічні властивості.
Окрім структурної ізомерії алкани мажуть мати оптичну ізомерію, при якій утворюються стереоізомери – молекули з однаковою брутто-формулою та структурною формулою, які відрізняються взаємним просторовим розташуванням атомів в молекулах. Наприклад: 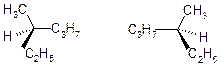 . Стереоізомери не можна сумістити в просторі. Стереоізомери, які відносяться один до одного як дзеркальні відображення, називаються енантіомерами. Енантіомери мають центр асиметрії або хіральний центр – атом карбону, який має чотири різних замісники. Енантіомери мають майже всі однакові хімічні та фізичні властивості. З фізичної точки зору енантіомери відрізняються лише знаком кута оптичного обертання: один енантіомер відхиляє плоскополяризований промінь світла вправо (+ енантіомер), другий – вліво (- енантіомер). Хімічні властивості енантіомерів в ахіральному (не асиметричному) середовищі однакові, в хоральному (асиметричному) відрізняються швидкістю здійснення реакції.
. Стереоізомери не можна сумістити в просторі. Стереоізомери, які відносяться один до одного як дзеркальні відображення, називаються енантіомерами. Енантіомери мають центр асиметрії або хіральний центр – атом карбону, який має чотири різних замісники. Енантіомери мають майже всі однакові хімічні та фізичні властивості. З фізичної точки зору енантіомери відрізняються лише знаком кута оптичного обертання: один енантіомер відхиляє плоскополяризований промінь світла вправо (+ енантіомер), другий – вліво (- енантіомер). Хімічні властивості енантіомерів в ахіральному (не асиметричному) середовищі однакові, в хоральному (асиметричному) відрізняються швидкістю здійснення реакції.
Стереоізомери які мають два або більше хіральних атомів карбону і не являються енантіомерами називають діастереомерами. Наприклад:
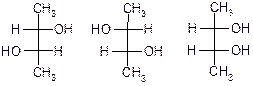 - Проекційні формули Фішера
- Проекційні формули Фішера
Діастереомери, на відміну від енантіомерів мають різні фізичні і хімічні властивості.
Для алканів характерне також явище поворотної ізомерії, яке реалізується внаслідок вільного обертання груп атомів навколо простого зв’язку С-С. Поворотні ізомери називаються конформерами. Серед безлічі конформерів, які можливі для молекули, починаючи з етану, відрізняють два конформери, які мають спеціальні назви. Це найбільш енергетично вигідний конформер, який має найменшу внутрішню енергію – загальмований конформер, та найменш вигідний конформер – заслонений конформер.
Проекційна формула Ньюмена: 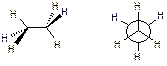
Різниця в енергіях конформерів обумовлена не валентними взаємодіями, тобто різним відштовхуванням електронів σ- зв’язків та атомів один від одного.
СПОСОБИ ОДЕРЖАННЯ АЛКАНІВ
І. Промислові способи
1. З природних джерел – газ, нафта та методи їх переробки.
2. Синтез Фішера-Тропша з карбон (ІІ) оксиду та гідрогену:
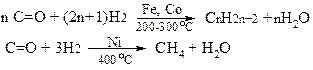
ІІ. Лабораторні способи
1. Реакція Вюрца

Схема реакції:
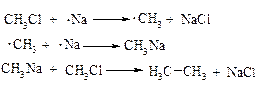
В реакцію Вюрца переважно вступають нерозгалужені галоїдні алкіли. При взаємодії з Na суміші алоїдних алкілів утворюється суміш алканів. Наприклад: 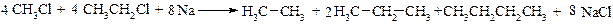
2. Реакція Кольбе – електрохімічне відновлення солей карбонових кислот
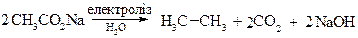
Схема реакції:
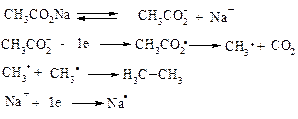
3. Декарбоксилування солей карбонових кислот
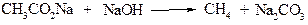
ХІМІЧНІ ВЛАСТИВОСТІ АЛКАНІВ
Для алканів характерні реакції заміщення та розщеплення. Розщеплення по зв’язку С-С вимагає меншої енергії (350 кДж/моль), ніж по зв’язку С-Н (413,7 кДж/моль). Але хімічні реакції здебільшого проходять по зв’язку С-Н, оскільки ці зв’язки більш доступні для реагентів.
І. Реакції заміщення. Місце входження замісники в молекулу насиченого вуглеводню визначається в першу чергу енергією зв’язку, вірогідність утворення та відносною стабільністю в ряду трет > втор > перв за рахунок прояву ефекту надспряження, то і енергія зв’язку С-Н збільшується у цьому ж напрямку:
| Енергія звязку, кДж/моль | 422,9 | 401,9 | 393,6 | 372,6 |
| Сполука | 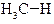
| 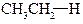
| 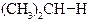
| 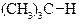
|
1. Галогенування. Реакційна здатність зменшується в ряду F>Cl>Br>I. Реакція з F2 проходить з вибухом, тому потрібно розведення інертним газом, наприклад, аргоном. Реакція з Cl2 та Br2 вже потребує високої температури (3000С) або ініціювання світлом. Реакція з I2 практично не відбувається.
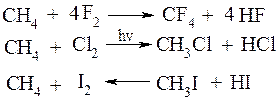
Відносна швидкість заміщення при хлоруванні: перв. (1); втор. (3,25); трет.(4,3)
Механізм реакції галогенування:
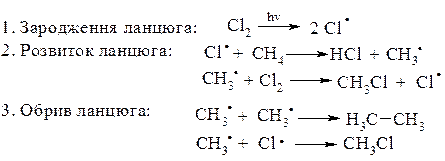
2. Нітрування розведеною нітратною кислотою за Коноваловим, парофазне нітрування при 250-5000С
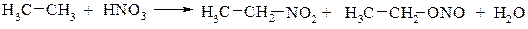
Механізм реакції:
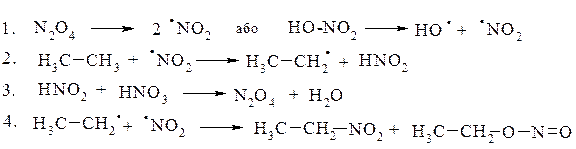
3. Сульфохлорування
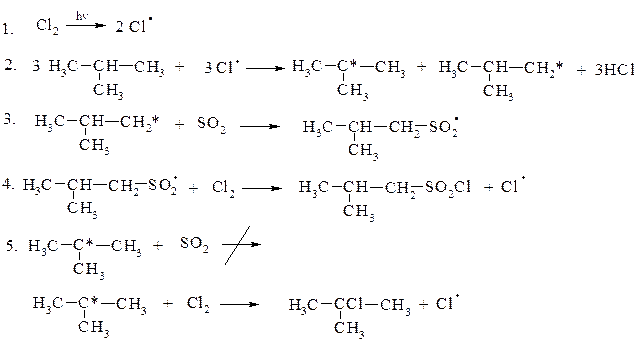
Сульфохлорування відбуваєтьтся лише за первинними та вторинними атомами карбону. Із-за просторових затруднень воно не можливе для третинних атомів карбону.
3. Сульфоокиснення: 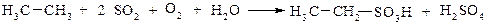
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 2390; Нарушение авторских прав?; Мы поможем в написании вашей работы!