
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окиснення
|
|
|
|

5. Крекінг: 
i. Диспропорціювання; 2. Рекомбінація; 3. β-розклад
АЛКЕНИ (ОЛЕФІНИ)
Алкенами називають вуглеводні, в молекулах яких знаходяться атоми вуглецю, які витрачають на з’єднання з сусіднім атомом карбону дві валентності, тобто утворюють подвійний зв’язок. Алкени утворюють гомологічний ряд загальної формули CnH2n
СПОСОБИ ДОБУВАННЯ АЛКЕНІВ
І. Реакції відщеплення
1. Дегідрування та піроліз алканів (промисловий спосіб) - відщеплення водню. Швидкість утворення алкенів та їх відносна стабільність зменшується в ряду:
R2C=CR2 > R2C=CHR > R2C=CH2 > RCH=CHR > RCH=CH2 > H2C=CH2, тобто із зменшенням числа замісників у подвійного зв’язку. Чим стабільніший алкен, тим легше він утворюється.

2. Дегідратація спиртів (відщеплення води).

Легкість дегідратації спиртів зростає в ряду первинний вторинний третинний. Правило Зайцева: в реакціях дегідратації або дегідрогалогенування найбільш легко відщеплюється атом водню від найменш гідрогенізованого (насиченого воднем) атому карбону, сусіднього по відношенню до атому карбону, який несе гідроксильну групу або атом галогену.

Причини цього явища:
a. Міцність зв’язків С-Н зменшується в ряду:
первинний атом Карбону > вторинний атом Карбону > третинний атом Карбону
b. Зростає стабільність алкенів, що утворилися, так як утворюється більш розгалужений алкен, який потребує меншої енергії активації процесу відщеплення.
3. Дегідрогалогенування галогеналканів (відщеплення галогеноводнів). Відбувається за правилом Зайцева.

4. Дегалогенування віцинальних дігалогеналканів (відщеплення галогенів)

ІІ. Реакція приєднання
1. Часткове гідрування (відновлення) алкінів (ацетиленів)
|
|
|

БУДОВА АЛКЕНІВ
Розглянемо будову найпростішого представника алкенів – етилену. Для утворення σ-зв’язків кожний sp2-гібридний атом карбону витрачає по три еквівалентні sp2-гібридизовані орбіталі. При осьовому перекриванні трьох sp2-орбіталей атому карбону з s-орбіталями атомів гідрогену або з sp2-орбіталями другого атому карбону утворюється три σ- зв’язки, які мають осьову симетрію відносно лінії зв’язку. Бокове перекривання не гібридизованих орбіталей двох атомів карбону приводить до утворення π- зв’язку. Внаслідок менш ефективного перекривання р-орбіталей утворюється π- зв’язок менш міцний, ніж σ- зв’язок.
Таким чином, С=С подвійний зв’язок збудований із міцного σ- зв’язку (347,5 кДж/моль) та відносно слабкого π- зв’язку (259,6 кДж/моль). Загальна енергія зв’язку становить 607,1 кДж/моль. Довжина зв’язку С=С в етилені дорівнює 0,134 нм, тоді як довжина зв’язку С-С в етині 0,154 нм. Відповідно, довжина зв’язку С-Н в етилені 0,108 нм, тоді як в етані – 0,110 нм.
sp2-Гібридизована орбіталь атому С в порівнянні з sp3-орбіталь має більший
s-характер внаслідок більш значного вкладу s-орбіталі. Відповідно, радіус sp2 –орбіталі менший від радіуса sp3 –орбіталі, а значить sp2 –гібридна орбіталь повинна утворювати з атомом Н коротший зв’язок, ніж sp3 –орбіталь, і відповідно – більш міцний. Дійсно, енергія зв’язку Сsp2-Н (435,5 кДж/моль) більша від енергії зв’язку Сsp3-Н (413,7 кДж/моль).
Цис-, транс- ізомерія. Присутність π- зв’язку в молекулах алкенів обумовлює неможливість вільного обертання навколо нього, що призводить до утворення геометричних ізомерів алкенів – енергетично невигідного цис-ізомеру (z-ізомеру) та енергетично вигідного транс-ізомеру (Е-ізомеру), в якому відсутнє взаємне відштовхування електронів σ- зв’язків та просторово об’ємних груп. При гідруванні транс-ізомеру бутену-2 виділяється на 4,1 кДж/моль менше енергії, ніж при гідруванні цис-ізомеру, тобто транс-ізомер має на 4,1 кДж/моль меншу внутрішню енергію і на стільки ж стійкіший цис-ізомеру. Аналогічно, при гідруванні більш розгалужених алкенів виділяється менше тепла, ніж при гідруванні менш розгалужених: .
.
|
|
|
ХІМІЧНІ ВЛАСТИВОСТІ
Найважливішим типом хімічних перетворень етиленових сполук є реакції приєднання за місцем подвійного зв’язку за рахунок розриву енергетично слабкішого π- зв’язку. π- Зв’язок є донором електронів, які легко утворюють
σ–зв’язки з реагентами, що приєднуються (аддендами). Залежно від природи аддендів та умов реакції (температура, природа розчинника) реакції приєднання можуть відбуватись за іоним електрофільним (АЕ) та радикальним механізмами (АR).
І. Реакції приєднання.
1. Гідрування – приєднання водню до ненасичених сполук.

Каталізатор: а) знижує енергію активації; б) не впливає на загальну зміну енергії реакції;
в) не впливає на рівновагу, тобто в однаковій мірі прискорює обидві реакції і пряму і зворотну. Тому його можна використовувати і для дегідрування.
Правило Лебедєва: Чим менше замісників при подвійному зв’язку олефіну, тим краще він адсорбується на поверхні каталізатору, тим легше гілкується олефін.
2. Галогенування – приєднання галогенів з утворенням віцинальних дігалогеналканів. Реакція прискорюється із збільшенням числа замісників при подвійному зв’язку внаслідок більшої поляризації подвійного зв’язку та більшої стабільності утворених проміжних частинок. Реакційна здатність галогенів зменшується в ряду F2 > Cl2 > Br2 > I2.

Реакція може відбуватись за радикальним або електрофільним механізмами:
а) Механізм АR (реалізується відносно рідко):

б) Механізм АЕ:

1. Перша (повільна) стадія реакції – електрофіл (галоген) повільно взаємодіє з π-електронами етиленового зв’язку з утворенням π-комплексу, в якому електрофіл утримується здебільшого за рахунок сил електростатичного при тяжіння. π-Комплекс легко утворюється й легко руйнується, так як має малу енергію активації утворення. Із збільшенням поляризації зв’язку Hlg-Hlg π-комплекс може переходити в нову різновидність – онієвий π-комплекс, в якому катіон Hlg утворює три центровий зв’язок з двома атомами карбону етиленового зв’язку. Поступово онієвий π-комплекс перетворюється в σ-комплекс, в якому π-електрони подвійного зв’язку витрачаються на утворення нового σ- зв’язку С-Hlg (олефін дає пару електронів, електрофіл – катіон галогену – вакантну орбіталь). π-Комплекс перетворюються в проміжну частину – карбкатіон (σ-комплекс).
|
|
|
2. Друга, швидка, стадія реакції – приєднання до проміжного карб катіону протилежно зарядженого аніону галогену, з утворенням кінцевого продукту реакції – аддукту. Приєднання противоіону відбувається за транс-механізмом, тобто з тильного боку відносно атому галогену, який вже приєднався.
3. Гідрогалогенування – приєднання галогеноводнів до ненасичених сполук.
а) Механізм АЕ – описується вище розглянутим механізмом

Правило Марковнікова. При гетеролітичному (іоному) приєднанні полярних молекул до алкенів електрофіл позитивна частина реагенту переважно приєднується до найбільш гідрогенізованого атому карбону подвійного зв’язку з утворенням більш стабільного проміжного карб катіону.
Такий напрямок приєднання реалізується внаслідок дії двох факторів.
а) Сатичний фактор – приєднання позитивно зарядженої частини (електрофілу) відбувається відповідно до поляризації подвійного зв’язку – до атому карбону з зарядом δ-:  .
.
б) Більш важливий динамічний фактор – при приєднанні завжди утворюється більш стійка проміжна частина (карбкатіон). Оскільки ж відносна стійкість карбкатіонів знижується в ряду: трет. > втор. > перв., реакційна здатність алкенів в реакціях АЕ зменшується в ряду:
(СН3)2С=СН2 > СН3СН=СНСН3 > СН3СН=СН2 >СН2=СН2
Швидкість приєднання галогеноводнів зменшується в ряду НI > НBr > НCl > НF відповідно із зменшенням міцності зв’язку Н-Hlg.
Пероксидний ефект Караша. Спостерігається лише для приєднання НBr в присутності кисню, пероксидів та інших джерел вільних радикалів. При радикальному механізмі приєднання галогеноводню проходить проти правила Марковнікова через стадію утворення більш стійкого радикалу. Відбувається по ланцюговому атомарно-радикальному механізму АR.
|
|
|
 Приєднання до алкенів HF та HCl завжди відбувається за правилом Марковнікова, тому що пероксиди не розкладають ці галогеноводні, так як гемолітичний розрив зв’язку в молекулах HF та HCl вимагає значно більшої енергії. Напроти, атоми І, які легко утворюються при розщепленні молекули НІ пероксидами, мало реакційно здатні і не реагують з алкенами.
Приєднання до алкенів HF та HCl завжди відбувається за правилом Марковнікова, тому що пероксиди не розкладають ці галогеноводні, так як гемолітичний розрив зв’язку в молекулах HF та HCl вимагає значно більшої енергії. Напроти, атоми І, які легко утворюються при розщепленні молекули НІ пероксидами, мало реакційно здатні і не реагують з алкенами.
4. Гідратація – приєднання води до ненасичених сполук.
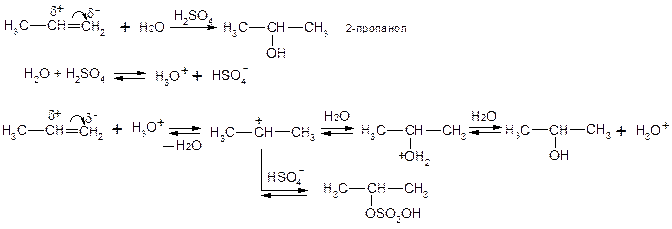
5. Гідрогалогеновування – приєднання HOHlg.

6. Полімеризація – утворення полімерів за рахунок з’єднання між собою великої кількості ненасичених молекул (мономерів) ковалентними зв’язками, які виникають внаслідок розриву π- зв’язків у молекулах мономерів. При невеликому ступені полімеризації утворюються олігомери. Розрізняють йонну та радикальну полімеризації в залежності від ініціаторів полімеризації.
Йонна полімеризація ненасичених мономерів відбувається при ініціюванні реакції катіонними та аніонними каталізаторами.
а) Катіонна полімеризація – у присутності каталізаторів H2SO4, HCl, BF3, AlCl3, TICl4.

б) Аніонна полімеризація – каталізатори Циглера – Натта:

1. Ініціювання: 
2. Ріст ланцюга: 
3. Обрив ланцюга:

Під дією каталізатора Ціглега-Натта в багатьох випадках утворюються стерео регулярні полімери. При полімеризації на каталізаторі, нанесеному на кристалічний носій добувають ізотактичні полімери або синдіотактичні полімери:

На аморфному носії утворюється атактичний полімер.
в) Радикальна полімеризація. Ініціатори  азодіізобутиронітрил.
азодіізобутиронітрил.

ІІ. Реакції окисненя.
Алкени легко окислюються за місцем етиленового зв’язку. Окислювачем можуть бути кисень повітря, О3, СuO, Ag2O, KMnO4, Cr2O3, OsO4, H2O2, над кислоти СН3СОООН та інші.
А. Окиснення без розриву зв’язку С-С:
1. Реакція Прилежаєва – взаємодія алкенів з H2O2, та іншими над кислотами з утворенням епоксидів:

2. Каталітичне окиснення киснем повітря:

3. Реакція Вагнера – утворення двохатомних спиртів – гліколей:

Відбувається за механізмом цис-циклоприєднання KMnO4 до подвійного зв’язку:

4. Окиснення в присутності солей Pd:

Б. Окиснення з розривом зв’язку С-С. Більш енергійна дія окислювачів (нагрівання, збільшення концентрації окиснювача) приводить до розриву молекули алкену за місцем подвійного зв’язку з утворенням карбоксильних сполук або карбонових кислот:
1. 
2. Озоноліз (за Гарієсом):

ІІІ. Реакції заміщення – алільне хлорування.
В реакціях радикального заміщення атоми гідрогену, зв’язані з атомами карбону подвійного зв’язку (вінільні атоми гідрогену), менш реакційно здатні, ніж атоми гідрогену, зв’язані з первинними атомами карбону в алканах. В той же час, атоми гідрогену, що зв’язані з атомами карбону, сусідніми по відношенню до подвійного зв’язку (алільне атоми гідрогену) більш реакційно здатні, ніж атоми гідрогену, що зв’язані з третинним атомом карбону в алканах:
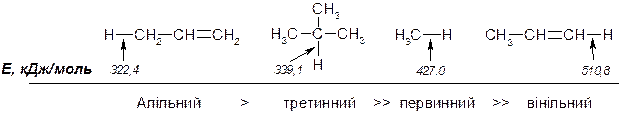
Це явище обумовлене високою стабілізацією алільного проміжного радикалу за рахунок ефекту спряження. Внаслідок, при термічному хлоруванні пропілену:

АЛКАДІЄНИ
Алкадієнами або дієновими вуглеводнями називають ненасичені вуглеводні з двома подвійними зв’язками. Загальна формула алкадієнів CnH2n-2.
Залежно від взаємного розміщення подвійних зв’язків поділяють на три групи:
а) Кумулени, в яких обидва подвійні зв’язки знаходяться біля одного атому карбону;

б) Дієни з ізольованими подвійними зв’язками, в яких подвійні зв’язки відділені однією або кількома групами СH2;

в) Спряжені (кон’юговані) дієни, які містять групу атомів С=С–С=С.

Для спряжених дієнів спостерігається так звані s-цис- та s-транс- ізомери. При цьому s-транс- ізомер 1,3-бутадієну на 12,6 кДж/моль енергетично вигідніший від s-цис-ізомеру.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 2052; Нарушение авторских прав?; Мы поможем в написании вашей работы!