
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Необратимая реакция второго порядка
|
|
|
|
Примером реакции второго порядка в растворе может служить омыление эфира щелочью:
СН3СООС2Н5 + NaOH ® CH3COONa + C2H5ОH.
В общем виде необратимая реакция второго порядка описывается стехиометрическим уравнением
А + В ® C + D.
Пусть в момент времени t = 0 имеется а моль вещества А и b моль вещества В. Пусть к моменту времени t прореагирует х моль вещества А. Из уравнения реакции ясно, что при этом прореагирует и х моль вещества В,
т.е. к моменту времени t останутся непрореагировавшими (а—x) моль вещества А и (b—х) моль вещества В. Если объем системы обозначить через V, то скорость реакции можно записать следующим образом:
-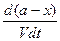 = k`
= k`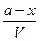
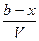 .
.
Сократив обе части уравнения на V и продифференцировав, получим
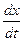 =
= 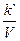 (a-x)(b-x).
(a-x)(b-x).
Если объем V системы постоянен, то его можно ввести в константу, т. е.
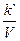 = k.
= k.
Тогда уравнение примет вид
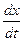 = k (а — x) (b — х).
= k (а — x) (b — х).
Уравнение и есть дифференциальное уравнение скорости необратимой реакции второго порядка. Интегрируя это уравнение c учетом начальных условий, получим
k = 
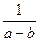 ln
ln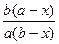 .
.
Если исходные количества веществ А и В будут равны, т.е. a = b, то дифференциальное уравнение скорости запишется так:
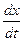 = k(a-x)2.
= k(a-x)2.
Разделив переменные и проинтегрировав в пределах от 0 до t и от 0 до х, получим k = 
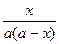 .
.
Когда количество прореагировавшего вещества будет равно половине исходного, т. е. когда х = а/2, значение t будет равно t, т. е. времени полураспада. Подставив эти величины в уравнение, получим
t = 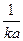 ,
,
т.е. время полураспада для реакции второго порядка обратно пропорционально количеству исходного вещества.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 526; Нарушение авторских прав?; Мы поможем в написании вашей работы!