
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория растворов сильных электролитов Дебая и Хюккеля
|
|
|
|
Сильные электролиты в растворе находятся практически только в виде ионов
KmAn → Kn+ + Am-
Однако, найденные опытным путем значения электрической проводимости, изотонического коэффициента, степени диссоциации и других показателей для сильных электролитов оказываются меньше, чем можно было бы ожидать при 100%-ной диссоциации.
Например: для K2SO4 теоретическое значение i=3. Экспериментальное значение i (определенное по понижению температуры замерзания) = 2,46. Экспериментальное значение степени диссоциации 73%.
С другой стороны полная диссоциация сильных электролитов на ионы подтверждается физическими и физико-химическими методами. Например, значения теплоты нейтрализации всех сильных кислот сильными основаниями практически одинаковы ΔH = -56,5 кДж/моль, что свидетельствует о полной диссоциации разбавленных растворов кислот и оснований.
Кроме того, исследование концентрированных растворов сильных электролитов оптическими методами показало отсутствие молекул в их растворах.
Приведенное противоречие объясняется в теории Дебая и Хюккеля электростатическим межионным взаимодействием в растворах.
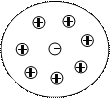 В водных растворах сильные электролиты практически полностью диссоциированы, в растворе содержится большое количество ионов, расстояние между которыми мало. В результате около каждого иона находятся преимущественно ионы противоположного знака, и образуется так называемая “ионная атмосфера”.
В водных растворах сильные электролиты практически полностью диссоциированы, в растворе содержится большое количество ионов, расстояние между которыми мало. В результате около каждого иона находятся преимущественно ионы противоположного знака, и образуется так называемая “ионная атмосфера”.
Как следствие, возникает эффект уменьшения числа ионов, участвующих в химических процессах. Ионы ориентируются друг относительно друга и поэтому их эффективная концентрация (активность) отличается от истинной.
Под активностью электролита x понимают эффективную концентрацию в соответствии с которой он участвует в различных процессах.
|
|
|
Активность связана с истинной концентрацией растворенного вещества
a(x) = f(x)∙C(x)
a(x) – активность электролита, моль/л
C(x) – концентрация, моль/л
f(x) – коэффициент активности (величина безразмерная)
Коэффициент активности 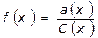 выражает отклонение раствора с концентрацией C(x) от поведения раствора при бесконечном разведении, т.е. в отсутствии межионных взаимодействий.
выражает отклонение раствора с концентрацией C(x) от поведения раствора при бесконечном разведении, т.е. в отсутствии межионных взаимодействий.
Если f(x) = 1 – это означает, что движения ионов не ограничены действием электростатических сил и a=C.
Если f(x) < 1, то на движение ионов оказывает влияние их электростатическое взаимодействие и вместо концентрации C надо подставлять активность a.
Если f(x) = 1 → a(x) = C(x)
Если f(x) < 1 → a(x) < C(x)
Активность (эффективная концентрация) ионов какого-то одного вида из-за их взаимодействия зависит от общего содержания ионов в растворе. Мерой этого общего содержания ионов является ионная сила раствора I
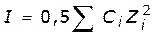
I – это полусумма произведений концентраций ионов на квадрат их зарядов. Для устранения влияния знака заряда необходимо возведение Z (заряда) в квадрат. Из определения следует, что ионная сила должна измеряться в тех же единицах, что и концентрация. (На практике часто ее пишут без размерности).
Ионная сила бинарного электролита, диссоциирующего на 2 однозарядных иона численно равна его концентрации.
[I] = [C] = [моль/л]
Например: AB (KCl → K+ + Cl-)
I = 0,5(0,1∙12 + 0,1∙12) = 0,1
Во сколько раз ионная сила больше концентрации для электролита типа A2B3, например для
Al2(SO4)3
Пусть концентрация данного электролита условно равна C
[Al+3] = 2C
[SO42-] = 3С
I = 0,5(2C∙32 + 3C∙22) = 15C, J = 15 С, т.е. в 15 раз
Еще рассмотрим пример: фосфатный буфер
Пусть C1 = C(NaH2PO4) = 0,1M
C2 = C(Na2 HPO4) = 0,05M
Находим концентрации ионов:
[Na+] = C1 + 2C2 = 0,1 + 2∙0,05 = 0,2M
[H2PO4-] = 0,1
[HPO42-] = 0,05
I = 0,5(0,2∙12 + 0,1∙12 + 0,05∙22) = 0,25
|
|
|
Рассмотрим на примере 0,01M раствора алюмокалиевых квасцов K2SO4∙Al2(SO4)3∙2H2O
[K+] = 0,01∙2 = 0,02
[SO42-] = 0,01∙4 = 0,04
[Al3+] = 0,01∙2 = 0,02
I = 0,5(0,02∙12 + 0,04∙22 + 0,02∙32) = 0,18
В 1923 Дебай и Хюккель показали, что для разбавленных водных растворов с ионной силой I ≤ 0,01 коэффициенты активности ионов можно рассчитать по формуле
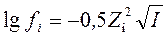
fi – коэффициент активности i-го катиона (аниона)
Zi – заряд i-го катиона (аниона)
Данное уравнение является математическим выражением предельного закона Дебая–Хюккеля (1921): в разбавленных растворах сильных электролитов с одинаковой ионной силой коэффициенты активности катионов и анионов одинаковой зарядности равны независимо от их химической природы.
Приведенная формула справедлива лишь для растворов с низкой ионной силой I ≤ 0,01, потому-то и выражает предельный закон.
Электрохимия - это раздел химии, который изучает закономерности химических реакций при действии электрического поля на вещество и, наоборот, электрические явления при химических реакциях. В первом случае электрическая энергия превращается в химическую, а во втором -химическая энергия переходит в электрическую. Введем некоторые понятия.
1) Проводники 1 рода - это металлы и сплавы, в них ток переносится электронами.
Для проводников I рода, как известно, сопротивление подсчитывается по формуле
(1) 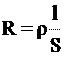 ρ - удельное сопротивление,
ρ - удельное сопротивление,
l - длина проводника,
S - площадь поперечного сечения.
2) Проводники II рода - это растворы и расплавы электролитов, в них ток переносится ионами.
Способность проводить электрический ток у растворов электролитов неодинакова и зависит от многих факторов, в частности от количества ионов и скорости их движения.
Чем больше концентрация ионов, тем сильнее электростатическое взаимодействие ионов, которое снижает их скорость.
При разбавлении водой сильных электролитов концентрация ионов, а следовательно, межионное взаимодействие, и тормозящие эффекты уменьшаются, поэтому растет скорость движения ионов,
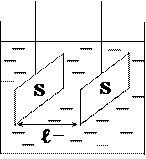 В растворах слабых электролитов концентрация ионов невелика, и поэтому их скорость движения практически не зависит от разбавления. Сопротивление растворов измеряют с помощью кондуктометрической ячейки.
В растворах слабых электролитов концентрация ионов невелика, и поэтому их скорость движения практически не зависит от разбавления. Сопротивление растворов измеряют с помощью кондуктометрической ячейки.
|
|
|
3) Кондуктометрическая ячейка- это сосуд
с двумя металлическими электродами площадью S,
находящихся на расстоянии l друг от друга (учебник
Ершова, стр. 452). С помощью кондуктометрической
ячейки измеряется сопротивление растворов.
Для электролитов используют понятие удельная электрическая проводимость. Эта величина обозначается буквой  (каппа).
(каппа).
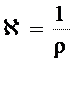 |
(2)
Численно удельная электрическая проводимость равна электропроводности раствора, находящегося между двумя электродами площадью 1м2 и отстоящими друг от друга на 1 м, т.е. это электропроводность 1 м3 раствора.
 Из уравнений (1) и (2) следует
Из уравнений (1) и (2) следует
Зависимость удельной электрической проводимости от разбавления представлена на следующем рисунке (учебник Ершова, стр. 454).

1 - слабый электролит,
2 - сильный электролит,
C - молярная концентрация вещества,
V - разбавление раствора, V=1/C
Исходное значение  сильных электролитов больше, чем слабых, т.к. у слабых электролитов низкая концентрация ионов. Вначале при разбавлении
сильных электролитов больше, чем слабых, т.к. у слабых электролитов низкая концентрация ионов. Вначале при разбавлении  растет, несмотря на уменьшение концентрации вещества в растворе. Для слабых электролитов это объясняется тем, что при разбавлении увеличивается α - степень диссоциации, поэтому увеличивается число ионов. Для сильных электролитов при разбавлении возрастает скорость движения их ионов за счет ослабления торможения ионами противоположного знака (эффект возникает потому, что ион движется в одну сторону, а противоположно заряженная ионная атмосфера - в другую).
растет, несмотря на уменьшение концентрации вещества в растворе. Для слабых электролитов это объясняется тем, что при разбавлении увеличивается α - степень диссоциации, поэтому увеличивается число ионов. Для сильных электролитов при разбавлении возрастает скорость движения их ионов за счет ослабления торможения ионами противоположного знака (эффект возникает потому, что ион движется в одну сторону, а противоположно заряженная ионная атмосфера - в другую).
В дальнейшем и для слабых, и для сильных электролитов  уменьшается, т.к. с разбавлением уменьшается концентрация ионов в растворе.
уменьшается, т.к. с разбавлением уменьшается концентрация ионов в растворе.
Более удобной для расчетов величиной является молярная электрическая проводимость. Она обозначается буквой λV, (лямбда).
Численно молярная электрическая проводимость равна электропроводности раствора, содержащего 1 моль эквивалента вещества и находящегося между электродами, отстоящими друг от друга на 1 м.
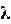
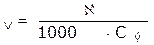
где λV - молярная электрическая проводимость,
|
|
|
Сэ - молярная концентрация эквивалента или нормальная концентрация раствора.
Зависимость молярной электрической проводимости от разбавления представлена на следующем рисунке (учебник Ершова, стр. 454).
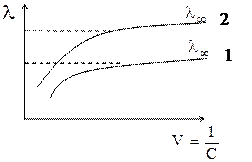 1 - слабый электролит,
1 - слабый электролит,
2 - сильный электролит,
C - молярная концентрация вещества,
V - разбавление раствора, V=1/C.
Как у сильных, так и у слабых электролитов λ, с разбавлением раствора возрастает и достигает максимального значения, которое называется предельной электрической проводимостью и обозначается λ∞. Это объясняется тем, что 1 моль эквивалента вещества содержится во все возрастающем объеме. При -этом в растворах сильных электролитов межионное взаимодействие становится очень слабым, и ионы не препятствуют движению друг друга. Скорость движения ионов достигает предельных значения, поэтому λ, перестает зависеть от разбавления и становится постоянной величиной. В растворах слабых электролитов λ, увеличивается ври разбавлении, т.к. α → 1 и увеличивается количество ионов, образуемых 1 моль электролита при данной температуре. Когда степень диссоциации достигает предельного значения, равного единице, дальнейшее разбавление не приводит к росту числа ионов в растворе.
Кольрауш установил, что при малых концентрациях, т.е. больших разведениях, катионы и анионы перемещаются независимо друг от друга.
Закон Кольрауша. Предельная молярная электрическая проводимость раствора электролита равна сумме молярных подвижностей анионов l A и катионов l K, входящих в состав этого электролита.
λ∞ = lA + lK
Значения молярных подвижностей ионов, входящих в состав биологических систем, приводятся в соответствующих таблицах (учебник Ершова, стр. 459).
| Ион | l∙104 Ом-1∙м2/моль |
| H+ | 349,8 |
| Na+ | 50,1 |
| K+ | 73,5 |
| ½ Ca2+ | 59,5 |
| ½ Fe2+ | 53,5 |
| ½ Cu2+ | 53,6 |
| OH- | 198,3 |
| Cl- | 76,3 |
| I- | 78,8 |
| CH3COO- | 40,9 |
| H2PO4- | 36,0 |
| HCO3- | 44,5 |
С помощью этих таблиц можно рассчитать λ∞ зная, из каких ионов состоит электролит, например:
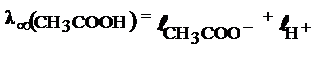 |
Самые высокие подвижности имеют ионы H+ и OH-.
Это объясняется особенностями перемещения
этих ионов в растворе. Предполагается, что
ионы H+ и OH- перемещаются по "эстафетному"
механизму. Схематично движение протона можно показать так:
В воде протон гидратирован. H+ скачкообразно движется от иона H3O+ к молекуле воды и т.д.
 Движение гидроксид-иона можно представить так:
Движение гидроксид-иона можно представить так:
От молекулы воды отрывается протон H+, перескакивает на ион OH-, а ион OH-, оставшийся от воды, перемещается в обратную сторону. Но ионы. OH- движутся медленнее, чем коны H+, т.к. отрыв H+ от молекулы воды, происходит труднее, чем от иона гидроксония H3O+. Другие катионы и анионы имеют меньшую подвижность, чем ионы H+ и OH-.
Кондуктометрия.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 4118; Нарушение авторских прав?; Мы поможем в написании вашей работы!