
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Комплекс Составные части
|
|
|
|
Ni(NH3)62+ Ni2+, NH3
[Co(NH3)6]SO4 [Co(NH3)6]2+, SO42-, Co2+, NH3
Лиганды («зубчатые структуры») могут быть бидентатными, монодентатными, полидентатнами. Дентатностью называется число донорных атомов лиганда, образующих координационные связи с центральным атомом.
Известно много монодентатных неорганических и органических лигандов, однако их применению в комплексометрии препятствует то, что ступенчатые константы устойчивости соответствующих комплексов мало различаются между собой. Поэтому при увеличении количества добавленного лиганда концентрация ионов металла изменяется постепенно и кривая титрования не имеет скачка.
Хелаты (хело-«клешня») – соединения, которые охватывают центральный ион. Важнейшая особенность хелатов – их повышенная устойчивость по сравнению с аналогично построенными нециклическими комплексами. Именно поэтому полидентатные лиганды и хелатные комплексы нашли широкое применение в аналитической химии.
Скорость комплексообразования имеет большое значение в аналитической химии. Например, при прямом комплексонометрическом титровании реакция определяемого иона с титрантом должна протекать практически мгновенно, иначе индикация конечной точки титрования существенно затрудняется.
Устойчивость комплекса определяется как фундаментальными факторами (природой комплексообразователя и лигандов), так и внешними условиями (температурой, природой растворителя, ионной силой, составом раствора).
Таким образом, комплексометрия основана на применении реакции образования комплексов Ме с аминополикарбоновыми кислотами. В результате реакции образуются внутрикомплексные соли (хелатные соли).
Комплексонами обычно называют органические соединения, представляющие собой производные аминополикарбоновых кислот. Простейший комплексон – нитрилотриуксусная кислота, известная под названием комплексон 1  .
.
|
|
|
Наибольшее значение имеет четырехосновная этилендиаминтетрауксусная кислота (ЭДТА) –комплексон 2.
Комплексоны наряду с карбоксильными группами содержат аминный азот. Благодаря такому строению эти соединения отличаются полидентантностью, т.е. способностью образовывать сразу несколько координационных связей с ионами металлов. На практике обычно применяют двунатриевую соль этилендиаминтетрауксусной кислоты, которую называют комплексоном 3.или трилоном Б. комплексон 3.
Комплексон 3 образует со многими катионами устойчивые малодиссоциированные растворимые в воде внутрикомплексные соли. Комплексоны широко применяются для качественного определения многих катионов.
Комплексон 1 – нитрилотриуксусная кислота (НТА, условно (X3Y):
 CH2COOH
CH2COOH
 HOOCCH2 – N
HOOCCH2 – N
CH2COOH или

| (дентат. = 4); |
Комплексон 2 - этилендиаминтетрауксусная кислота (ЭДТА, условно XH4Y):
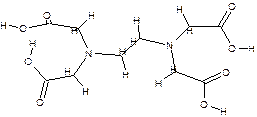
| (дентат. =6); |
Комплексон 3- дигидрат двунатриевой соли этилендиаминтетрауксусной кислоты (условно Na2H2Y).
Комплексоны 1,2 и 3 сильные органические кислоты, диссоциируют ступенчато, причем степень диссоциации зависит от pH.
Так, комплексон 3 в воде диссоциирует согласно уравнениям:

Комплексон 2 диссоциирует:

В сильно кислых растворах с pH<3 образуются менее устойчивые комплексные соединения. В сильнощелочных растворах с pH>10 могут выпадать осадки гидроокисей металоов. Поэтому при комплексометрическом титровании нужно поддерживать pH в интервале от 3 до 10. При этом для каждого катиона существует свое строго определенное значение pH, при котором комплекс наиболее устойчив. Поэтому для поддержания определенного значения pH готовят буферные растворы. Титрование большинства катионов обычно проводят в аммиачной буферной среде  при pH=8-9. В кислой же среде только некоторые катионы образуют прочные комплексы с комплексонами.
при pH=8-9. В кислой же среде только некоторые катионы образуют прочные комплексы с комплексонами.
|
|
|
6. 2 Комплексонометрическое титрование.
Суть комплексометрического титрования заключается в следующем. Титрантом является комплексон 2, реже 3. В раствор, в котором содержится определяемый ион добавляют определенное количество металлиндикатора. Металлиндикатор образует с определяемым ионом Ме окрашенный комплекс. Раствор начинают титровать комплексоном 3. Комплекс с металлоиндикатором постепенно разделяется и образуется новый, более устойчивый комплекс Ме с комплексоном – другого цвета. В точке эквивалентности первоначальный цвет соединения Ме с индикатором исчезает и появляется окраска, свойственная свободному индикатору.
Таким образом, комплексонометрия (хелатометрия), представляет собой титриметрический метод анализа, основанный на использовании реакций ионов металлов с комплексонами, сопровождающихся образованием устойчивых малодиссоциирующих внутрикоплексных солей.
При титровании комплексоном 3 солей протекают следдующие реакции: реакция1
Комплексоны вступают в реакции с катионами многих металлов в отношении 1:1, образуя малодиссоциирующие растворимые в воде комплексы, соли, называемые комплексонатами:

Катионы Mg2+, Ca2+, Sr2+, Ba2+, Al3+, Mn2+, Cd2+, Zn2+, Fe2+, Co2+, Ni2+, Cu2+ образуют с комплексонами в кислой и нейтральной средах соединения состава H[Me2+X3-] или [Me2+X3-].
Например, катионы кальция связываются с комплексоном 3 по уравнению:
Ca2+ + Na2H2Y Û Na2[ CaY ] + 2H+.
Комплексные соли комплексона 3 (трилона Б) с металлами называют соответственно трилонатами. Внутрикомплексные ионы, образуемые трилоном Б с ионами Me2+, имеют следующее строение:

Трилон Б образует прочные растворимые в воде комплексные соединения с большим числом катионов металлов путем замещения атомов водорода карбоксильных групп на металл и координации последнего с азотом.
Прочность трилонатов очень велика.Так, например, константа устойчивости трилоната никеля равна bNiY2-= 4,2. 1018. На устойчивость этих внутрикомплексных ионов мало влияют температура и органические растворители. При всех значениях pH катионы металлов любой степени окисления реагируют в отношении 1:1. На основании величин констант нестойкости комплексов сделаны выводы, что у двухзарядных катионов трилонаты устойчивы в щелочных и аммиачных растворах, а у трехзарядных - даже в кислых растворах. С увеличением степени окисления металла прочность комплексонатов (трилонатов) возрастает.
|
|
|
6. 3 Индикаторы, применяемые в комплексонометрии
В комплексонометрии чаще всего для фиксирования момента эквивалентности применяют индикаторы, меняющие свой цвет в зависимости от концентрации ионов металла в растворе, а поэтому называющиеся металлоиндикаторами. Они являются органическими красителями и в свободном состоянии окрашены. С катионами металлов они образуют внутрикомплексные интенсивно окрашенные соединения (отличающиеся по цвету от окраски индикатора в свободном состоянии).
HInd2- + Me2+ Û MeInd- + H+
синий красный
Если к раствору такого соединения добавить титрованный раствор комплексона III (трилона Б), то внутрикомплексное соединение металла с индикатором разрушается и образуется новое внутрикомплексное соединение, более прочное (трилонат). Освободившиеся молекулы (ионы) индикатора изменяют окраску раствора:
MeInd- + HI3- Û MeI2- + HInd-.
красный синий
Таким образом, в точке эквивалентности наблюдается переход от окраски раствора комплекса металла с индикатором (например, красной) к окраске самого индикатора. Если металл связан прочнее с индикатором, чем с комплексоном (т.е. устойчивость комплексоната меньше), то титрование невозможно (индикатор «блокирован»). Так как индикаторы изменяют окраску также и с изменением значений pH раствора, то титровать необходимо в буферных растворах.
Важнейшие индикаторы - эриохром черный Т и мурексид.
Эриохром черный Т (хромоген черный специальный ЕТ-00) - азокраситель, 0,0-диоксиазосоединение C20H13O7Na3S (условноH3Ind):

Индикатор диссоциирует с образованием Н+, Н2Ind-, HInd2-, Ind3-, поэтому эриохром чёрный Тспособен реагировать с ионами металла-комплексообразователя с образованием комплексных соединений. Сам индикатор окрашен в синий цвет. В нейтральной или щелочной среде при рН= 7...10 он образует с ионами металлов соединения красного цвета.
|
|
|
Чтобы окраска комплекса резко отличалась от окраски самого индикатора, титрование суказанным индикатором ведут при pH=9,3 (в присутствии аммиачного буфера) с образованием комплексных соединений красного цвета.
Мурексид (аммонийная соль пурпурной кислоты):
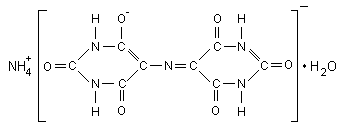
Мурексид представляет собой тёмно-красный порошок. Водный раствор мурексида окрашен в фиолетово-красный цвет, изменяющийся в зависимости от среды: при рН < 9 – красно-фиолетовый, рН =9...10 –фиолетовый, рН >11 синефиолетовый. С катионами металлов мурексид образует комплексные растворимые в воде соединения красного или жёлтого цвета. Комплексы металлов с мурексидом имеют значительную устойчивость. Их прочность повышается с увеличением pH. Наиболее устойчивы комплексы с медью. С Ca2+ мурексид образует красный комплекс, с ионами Cu2+, Ni2+, Co2+ образует желтый комплекс.
При определении содержания ионов Ca2+ следует создавать значение pH > 12, так как при этом резче происходит переход окраски от красной к сине-фиолетовой. При определении содержания ионов Cu2+, Co2+ создают pH = 9 (аммонийным буфером), при этом происходит переход окраски от желтой к красно-фиолетовой.
Кроме того, применяют как индикаторы кислотный хром синий, кислотный темно-синий, сульфосалициловую кислоту и др.
6. 4 Способы комплексометрического титрования
В настоящее время комплексоны (и особенно трилон Б) применяют в самых различных методах анализа - колориметрии, потенциометрии, гравиметрии и др. В титриметрическом анализе комплексоны применяют для определения общей жесткости воды, для анализа различных фармацевтических препаратов и т. д. Такое широкое распространение комплексонов, особенно, трилона Б связано прежде всего с тем, что из одной пробы анализируемого раствора можно определять до пяти катионов при различных значениях pH раствора, а также с большой точностью метода.
Приемы комплексометрического титрования могут быть различными: прямое титрование, обратное, титрование по методу вытеснения и алкалиметрическое.
6.4.1 Прямое титрование
В бюретку наливают титрованный раствор трилона Б, в колбу для титрования - раствор, содержащий ион металла. Этот раствор перед титрованием доводят до определенного значения pH 9...10 (добавлением буфера, например, аммонийного). Титрование проводят в присутствии металлоиндикатора, реагирующего на изменение показателя концентрации иона металла в растворе (точнее, на изменение показателя концентрации иона металла pMe аналогично тому, как pH-индикатор реагирует на изменение pH). Раствором трилона Б титруют до тех пор, пока все катионы металла из комплекса с металлоиндикатором не перейдут в комплексонат, что сопровождается изменением окраски раствора в конечной точке.
Этим методом определяют ионы многих металлов, например, кальция, бария, стронция, никеля и др.
6.4. 2 Обратное титрование
В том случае, когда надежный индикатор на ион металла отсутствует или pH, необходимый для образования комплекса вызывает осаждение определяемого металла, применяют метод обратного титрования. Титрованный раствор трилона Б добавляют в заведомом избытке к раствору анализируемой соли. Устанавливают, вводя буферный раствор, нужное значение pH. Избыток трилона Б оттитровывают раствором хлорида магния или хлорида цинка. Точка эквивалентности фиксируется по изменению окраски индикатора (например, эриохрома черного Т). Обратное титрование применяют также, когда ионы металла взаимодействуют с титрантом или металоиндикатором медленно.
6.4 3 Титрование путем вытеснения
Этот метод применяют в тех случаях, когда:
1) определяют содержание металла, входящего в состав труднорастворимого осадка (например, MgNH4PO4);
2) нет подходящего индикатора для прямого титрования в случае блокировки индикатора (то есть индикатор связан с металлом в более прочный комплекс, чем комплекс металла с трилоном);
3) реакция идет очень медленно.
В этом случае можно соединение с комплексоном получить обменной реакцией при титровании соли определяемого металла с ЭДТА (например, раствором комплексоната магния Na2[ MgY ] или цинка Na2[ZnY]). К анализируемому раствору прибавляют комплексонат магния (его получают титрованием или используют готовый), реакция идет по уравнению:
Me2+ + Na2[ MgY ] Û Na2[ MeI ] + Mg2+ .
Mg2+ вытесняется в количестве, эквивалентном количеству ионов металла, связанных в прочный комплекс с ЭДТА. Вытесненный Mg2+ титруют трилоном Б.
Для применения этого метода необходимо, чтобы образующееся соединение определяемого металла с комплексоном было более прочным, чем комплексонат магния или цинка.
6.4. 4 Алкалиметрическое титрование (титрование щёлочью)
Это титрование, основанное на изменении значения pH раствора (при взаимодействии иона металла и трилона Б):
Me2+ + [ H2I ]2- Û [ MeI ]2- + 2H+ .
Выделение H+ строго эквивалентно содержанию металла, поэтому раствор далее титруют 0,1н раствором NaOH с индикатором метил-оранжевым или метиловым-красным.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1742; Нарушение авторских прав?; Мы поможем в написании вашей работы!