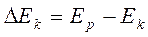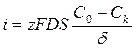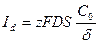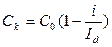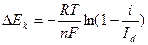КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение концентрационной поляризации
|
|
|
|
Напоминаю, сдвиг электродного потенциала от равновесного значения при протекании тока, обусловленный замедленностью стадии диффузии, называется концентрационной поляризацией.
Почему поляризация “концентрационная”?
Потому, что диффузия возникает по причине изменения (в частности уменьшения) концентрации ионов электролита у поверхности электрода вследствие электролиза.
Концентрационная поляризация изучается в разделе диффузионной кинетики электродных процессов.
Концентрационная поляризация, а, следовательно, и диффузионная кинетика наблюдается в области большего сдвига потенциала, чем при электрохимической поляризации.

Итак, рассмотрим катодную концентрационную поляризацию на примере следующего элемента:
(-) Ag | AgNo3, aq | Pt (+)
Напоминаю, что наиболее медленной стадией является не процесс разряда ионов Ag+ к поверхности электрода и именно эта стадия определяет скорость всего электрохимического процесса.
 В начальный момент времени, когда элемент не подключен к в.и.н., через электроды не протекает ток, на границе электрод-раствор существует электрохимии-ческое равновесие, а значит Ек = Ер и описывается уравнением Нернста:
В начальный момент времени, когда элемент не подключен к в.и.н., через электроды не протекает ток, на границе электрод-раствор существует электрохимии-ческое равновесие, а значит Ек = Ер и описывается уравнением Нернста:
электрохимическое равновесие 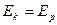 ;
;


где С0 – концентрация ионов электролита у поверхности электрода, равная исходной концентрации электролита.
При протекании через электрод электрического тока величина электродного потенциала отличается от своего равновесного значения 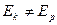 . Начинается процесс электролиза и на катоде протекает следующий процесс:
. Начинается процесс электролиза и на катоде протекает следующий процесс:
К (-): Ag+ + 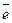 → Ag0 ↓
→ Ag0 ↓
разряд ионов Ag+
В результате электролиза концентрация ионов Ag+ у поверхности катода уменьшается до некоторой величины Ск. Тогда значение Ек будет равно:

Отношение Ек от величины Ер приводит к возникновению концентрационной поляризации:
|
катодная концентрационная поляризация (“-”)
Тогда 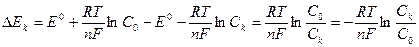
n = 1: (т. к. катодная поляризация имеет более
отрицательные значения)
Найдем величину Ск (концентрация ионов электролита у поверхности электрода после начала электролиза) и выведем уравнение для 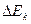 .
.
Т. к. количество ионов Ag+ у катода меньше (вследствие восстановления и оседания Ag0 на электроде) чем в остальной части раствора (где C0 > Ck и C0 = const) то ионы Ag+ перемещаются – диффундируют из глубины раствора к катоду. В целом электрохимический процесс катодного восстановления Ag+ будет лимитироваться стадией диффузии Ag+ к поверхности катода.
Плотность тока i, которая обусловлена диффузией ионов к поверхности электрода, называется диффузионным током:
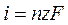 [ А/см2 ]
[ А/см2 ]
где n – количество продифундировавших ионов;
z – заряд иона;
F – число Фарадея.
Количество ионов, которое диффундирует к катоду в единицу времени, описывается согласно закону Фика:
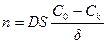
где D – коэффициент диффузии;
S – площадь поверхности электрода;
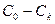 - разность концентраций в глубине раствора и у поверхности катода;
- разность концентраций в глубине раствора и у поверхности катода;
δ – толщина диффузионного слоя (это расстояние от поверхности катода до точки в глубине раствора, где достигается начальная концентрация (С0) раствора;
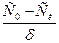 - градиент концентраций – это разность концентраций
- градиент концентраций – это разность концентраций 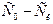 , отнесенная к толщине диффузионного слоя.
, отнесенная к толщине диффузионного слоя.
Тогда диффузионный ток равен:
|
i определяется диффузией только части ионов в раствор 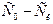 .
.
С ростом i величина Ск уменьшается (из-за электролиза). Величина диффузионного тока, при которой концентрация ионов у поверхности электрода становится равной 0, называется предельным диффузионным током:
|
Т. е. все ионы Ag+ которые находятся у поверхности электрода, при таком i сразу восстанавливаются до Ag.
При этом, в отличие от i, величина Id определяется диффузией всех ионов в растворе С0.
Разделим i на Id и найдем величину Ск.
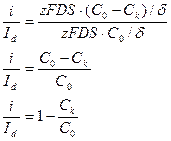
|
Подставим величину 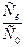 в уравнение ∆Ек:
в уравнение ∆Ек:
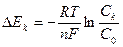
|
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1737; Нарушение авторских прав?; Мы поможем в написании вашей работы!