
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства алканов
|
|
|
|
Предельные углеводороды при обычных условиях химически инертны. Это объясняется большой прочностью неполярных и малополярных σ-связей С−С и С−Н. Алканы не вступают в реакции присоединения, при умеренных температурах не взаимодействуют с сильными окислителями. При сравнительно низких температурах протекает лишь небольшое число реакций замещения, при которых происходит замена атомов водорода на другие атомы и группы.
1.3.1. Реакция галогенирования
Смесь простого алкана (метана, этана, пропана) и хлора может существовать без следов взаимодействия при комнатной температуре в темноте. Однако облучение такой смеси ультрафиолетовым светом или нагревание до 300о приводит к бурной экзотермической реакции с образованием галогенозамещенных углеводородов (галогеналканов) по уравнению:
 RH + X2 RX + HX (Х: Сl, Br; R: алкил)
RH + X2 RX + HX (Х: Сl, Br; R: алкил)
 СН4 + Сl2 CH3Cl + HCl
СН4 + Сl2 CH3Cl + HCl
метан хлорметан
Реакция протекает по свободнорадикальному механизму, который включает следующие стадии:
1. Инициирование. Процесс начинается с поглощения молекулярным хлором кванта УФ-света и распада на два радикала:
 Сl : Cl 2 Cl ·
Сl : Cl 2 Cl ·
2. Рост цепи. Образовавшийся атом хлора может оторвать атом водорода от молекулы метана с получением метильного радикала и хлористого водорода:
 CH4 + Cl · CH3 · + НCl
CH4 + Cl · CH3 · + НCl
Свободный метильный радикал может дальше оторвать атом хлора от молекулы хлора и образовать хлористый метил и новый атом хлора:
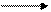 CH3 · + Cl2 CH3Cl + Cl ·
CH3 · + Cl2 CH3Cl + Cl ·
Реакции такого типа называются цепными, поскольку один атом хлора может инициировать хлорирование бесконечного числа молекул метана.
3. Обрыв цепи. На практике протекание процесса галогенирования ограничивается обрывом цепи, при которых два радикала реагируют друг с другом:
|
|
|
 CH3 · + Cl · CH3Cl
CH3 · + Cl · CH3Cl
 Cl · + Cl · Cl2
Cl · + Cl · Cl2
В этой реакции образуются не только монозамещенные, но и ди-, три- и тетразамещенные производные метана:
 CH3Cl + Cl2 CH2Cl2 (дихлорметан, хлористый метилен)
CH3Cl + Cl2 CH2Cl2 (дихлорметан, хлористый метилен)
 СH2Cl2 + Cl2 CHCl3 (трихлорметан, хлороформ)
СH2Cl2 + Cl2 CHCl3 (трихлорметан, хлороформ)
 CHCl3 + Cl2 CCl4 (тетрахлорметан, четыреххлористый углерод)
CHCl3 + Cl2 CCl4 (тетрахлорметан, четыреххлористый углерод)
При хлорировании разветвленных алканов следует иметь в виду, что замещение атомов водорода при различных углеродных атомах протекает неодинаково. В первую очередь замещается водород при третичных атомах углерода, затем при вторичных, и в последнюю очередь замещается водород при первичных атомах углерода. В итоге, как правило, получается смесь продуктов галогенирования.
Сl
hν |
 СH3−CH−CH2−CH3 + Сl2 СH3−C−CH2−CH3 +
СH3−CH−CH2−CH3 + Сl2 СH3−C−CH2−CH3 +
| |
CH3 CH3
2-метилбутан 2-метил-2-хлорбутан
Сl
|
+ СH3−CН−CH−CH3 + СlСH2−CH−CH2−CH3 + СH3−CН−CH2−CH2Сl
| | |
СН3 СН3 СН3
2-метил-3-хлорбутан 2-метил-1-хлорбутан 3-метил-1-хлорбутан
1.3.2. Нитрование алканов (реакция Коновалова)
Протекает по свободнорадикальному механизму в условиях высокой температуры, которая способствует распаду молекул азотной кислоты на активные частицы.
t > 450
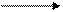 RH + HNO3 RNO2 + H2O
RH + HNO3 RNO2 + H2O
По аналогии с хлорированием процесс нитрования включает следующие стадии:
t
 a) HO : NO2 HO · + · NO2
a) HO : NO2 HO · + · NO2
 б) RH + · OH R · + H2O
б) RH + · OH R · + H2O
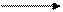 в) R · + · NO2 RNO2
в) R · + · NO2 RNO2
 г) R · + HONO2 RNO2 + · OH и т. д.
г) R · + HONO2 RNO2 + · OH и т. д.
 CH3−CH3 + HNO3 CH3−CH2 −NO2
CH3−CH3 + HNO3 CH3−CH2 −NO2
этан нитроэтан
При нитровании этана и высших алканов образуются только мононитропроизводные.
При высоких температурах протекают реакции с разрывом как С−Н, так и С−С – связей: горение, дегидрирование, крекинг, изомеризация.
1.3.3. Горение алканов
Алканы горят на воздухе с выделением большого количества тепла:
 2 C2H6 + 7 O2 4 CO2 + 6 H2O
2 C2H6 + 7 O2 4 CO2 + 6 H2O
1.3.4. Реакции дегидрирования
При сильном нагревании (выше 1000 ºС) разлагаются на простые вещества:
 CH4 C + 2 H2
CH4 C + 2 H2
Если метан нагреть до более высокой температуры (1500 ºС), то образуется ацетилен:
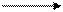 2 CH4 H−C≡C−H + 3 H2
2 CH4 H−C≡C−H + 3 H2
|
|
|
Эта реакция имеет большое практическое значение, так как открывает путь к синтезу многих органических соединений.
Под действием катализаторов и при высокой температуре алканы отщепляют водород и превращаются в непредельные углеводороды:
Cr2O3, t
 CH3−CH3 CH2=CH2 + Н2
CH3−CH3 CH2=CH2 + Н2
этан этилен
1.3.4. Крекинг алканов
Пиролиз или крекинг алканов при высоких температурах и давлениях без доступа воздуха приводит к расщеплению молекул:
 C8H18 C4H10 + C4H8
C8H18 C4H10 + C4H8
октан бутан бутен
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 360; Нарушение авторских прав?; Мы поможем в написании вашей работы!