
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 3. Химическая связь
|
|
|
|
План
1. Общая характеристика химической связи.
2. Ковалентная химическая связь.
3. Ионная химическая связь.
4. Металлическая и водородная химическая связь.
1. Химическая связь – это электростатическое взаимодействие двух атомов или многоатомных систем, осуществляемое путем обмена электронами. Важнейшими параметрами химической связи являются длина и энергия. Расстояние между ядрами двух связанных атомов называется длиной связи. Например, в молекуле Н2О расстояние меду ядрами водорода и кислорода составляет 0,096 нм. Угол меду воображаемыми прямыми, проходящими через ядра химически связанных атомов, называется валентным углом. В молекуле Н2О он равен 104,5 оС. Мерой прочности связи является энергия связи, определяемая работой, которая необходима для разрушения связи. Например, энергия связи Н-Н в молекуле Н2 равна 435 кДж/моль.
В зависимости от того, как происходит обмен электронами выдяляют следующие виды химической связи: ковалентную, ионную, металлическую и водородную.
2. Ковалентная связь – это связь, осуществляемая за счет образования общих электронных пар, принадлежащих обоим атомам. Общая электронная пара может быть образована двумя способами: 1) каждый из атомов отдает в общее пользование по одному электрону (обменный механизм); 2) один атом отдает в общее пользование два электрона, а другой предоставляет пустую орбиталь (донорно-акцепторный механизм).
Обменный механизм: Н· + ·Н 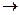 Н: Н
Н: Н
Примером донорно-акцепторного механизма образования ковалентной связи является образование иона аммония – NH4NO3.
По способу перекрывания электронных орбиталей различают ϭ и π-ковалентные связи. В молекуле N2 электронаая пара образуется за счет образования ϭ-связи (эектронаая плотность находится в одной области, вдоль линии соединяющей ядра атомов). При боковом перекрывании р-орбиталей в двух областях образуется π-связь.
|
|
|
По числу электронных пар образующих атомы различают ковалентные связи:
· Одинарные (Н2, СН4);
· Двойные (СО2, С2Н4);
· Тройные (N2, С2Н2).
По степени смещения электронной пары выделяют неполярную и полярную ковалентную связь. Ковалентная химическая связь образующаяся между атомами с одинаковой электроотрицательность, называется неполярной. Например, Н2, СI2, N2. Если взаимодействующие атомы имеют различную электроотрицательность (атомы разных элементов), то общая электронаая пара смещается к атому с большей электроотрицательностью. В данном случае возникает полярная ковалентная связь (Н· + ·СI 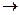 Н:CI). Полярность связи обозначают стрелкой, направленной в сторону атома с большей электроотрицательностью: Н
Н:CI). Полярность связи обозначают стрелкой, направленной в сторону атома с большей электроотрицательностью: Н 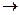 CI.
CI.
3. Ионная химическая связь – это связь, образующаяся за счет электростатического взаимодействия ионов (катионов и анионов). Классическим примером образования является образование фторида натрия. При взаимодействии атомов натрия (электроотрицательность 0,93) с атомами фтора (электроотрицательность 4,10) происходит переход электронов атома с меньшей электроотрицательностью к атому с большей элкктроотрицательностью:
Na· + ·F 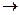 Na+ +:F-
Na+ +:F-
Образующиеся частицы называются ионами. Все ионные соединения в твердом состоянии являются кристаллическими веществами. Они имеют ионную кристаллическую решетку. Основное свойство ионной связи – направленность. В кристалле NaCI каждый ион натрия притягивается ко всем ионам хлора и наоборот.
4. Металлическая связь – это связь между положительными ионами в кристаллах металлов, осуществляемая за счет общих электронов, свободно перемещающихся по кристаллу. Валентные электроны атомов металлов слабо связаны с ядрами атомов и могут легко отрываться от них. В результате в кристаллической решетке металла появляются положительно заряженные ионы и свободные электроны. В кристаллической решетке металлов существует большая свобода перемещения электронов. Связь между ионами осуществляется за счет большого количества электронов, свободно перемещающихся в поле положительных центров. Металлическая связь (как и ионная) характеризуется ненаправленностью, в ней принимают участие все атомы кристалла металла.
|
|
|
Химическая связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы называется водородной. Механизм образования водородной связи имеет частично электростатический, частично донорно-акцепторный характер. Такая связь образуется между молекулами воды и этилового спирта. В белках вторичная структура обеспечивается наличием водородных связей между карбонильным атомом кислорода и водородом аминогруппы. Эта связь имеется и в ДНК в которой две цепи нуклеотидов связаны водородной связью.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 606; Нарушение авторских прав?; Мы поможем в написании вашей работы!