
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обратимые химические реакции. Химическое равновесие
|
|
|
|
Каталитический конвертор
Одной из важнейших областей применения каталитических реакций в автомобилестроении является использование катализаторов дожигания топлива - каталитических конверторов. Необходимость катализатора дожигания обусловлена, во-первых, неполным сгоранием углеводородного топлива, в результате чего в выхлопных газах содержится большое количество угарного газа – оксида углерода (II), во-вторых, азотсодержащие вещества, входящие в состав нефтепродуктов при сгорании в двигателе образуют оксиды азота (II) и (IV). Вышеперечисленные соединения обладают токсичным действием на человеческий организм и, кроме того, оказывают отрицательное воздействие на окружающую среду
Таким образом, при конструировании каталитического конвертора нужно создать условия для реакции окисления CO и несгоревших углеводородов (например, метана CH4) до углекислого газа – оксида углерода (IV) CO2. С другой стороны этот же катализатор должен обеспечить восстановление оксидов азота NO и NO2 до неопасного азота N2. Сочетание таких противоречивых требований смог обеспечить только комплексный катализатор на основе платины (реже палладия) и родия. Причем на поверхности платины протекают реакции окисления, а на поверхности родия, которого требуется в 5 раз меньше, идут реакции восстановления.
Поскольку и платина, и палладий, и родий являются драгоценными металлами, для экономии их наносят на поверхность керамического носителя на основе оксидов алюминия и меди, выполненного для большей площади контакта с выхлопными газами в форме сот.
Несмотря на высокую эффективность, каталитические конверторы имеют ряд существенных недостатков, к которым относятся, прежде всего, высокая стоимость и очень высокая чувствительность к качеству топлива. Этилированный бензин, содержащий тетраэтилсвинец (Pb(CH3)4), практически сразу же отравляет поверхность катализатора, выводя его из строя.
|
|
|
Обратимые реакции - химические реакции, протекающие при данных условиях одновременно в двух противоположных (прямом и обратном) направлениях:
¾ прямая реакция ®
aA + bB «cC + dD
¬ обратная реакция ¾
Рассмотрим обратимую химическую реакцию окисления оксида азота (II) кислородом воздуха в оксид азота (IV):
2NO (Г) + O2 (Г) = 2NO2 (Г)
Первоначально в системе присутствуют только исходные вещества, их концентрация максимальна, соответственно максимальной будет и скорость прямой реакции:
2NO (Г) + O2 (Г) ® 2NO2 (Г)
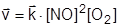 . .
| (10) |
По мере образования NO2 исходные вещества расходуются, их концентрация падает, и скорость прямой реакции уменьшается.
Поскольку NO2 не является в условиях реакции стабильной молекулой, то начинается постепенный распад этого вещества на исходные по обратной реакции. Причем скорость обратной реакции в первоначальный момент времени равна 0 (NO2 в системе нет), а затем эта скорость постепенно увеличивается:
2NO2 (Г) ® 2NO (Г) + O2 (Г)
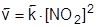 . .
| (11) |
В определенный момент времени скорость прямой и обратной реакций станет равной (рис. 1.6.). В этот момент в системе наступит химическое равновесие. Сколько NO2 образуется по прямой реакции, столько же NO и O2 образуется по обратной, поэтому концентрации веществ перестанут изменяться и станут постоянными.
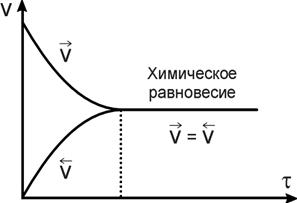
Рис. 1.6. Зависимость скорости прямой и обратной реакции от времени.
Особенностью химического равновесия является его динамический характер, т.е. неизменность концентрации веществ во времени является не следствием прекращения химических реакций в системе, а результатом взаимной компенсации прямой и обратной реакции.
Поскольку 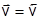 , можно записать:
, можно записать:
|
|
|
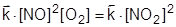 . .
| (12) |
Отсюда:
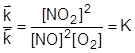 . .
| (13) |
Так как константы скорости прямой и обратной реакции являются величинами постоянными, то и их отношение является постоянной величиной и называется константой равновесия химической реакции (K).
В общем случае для реакции:
аА + bВ = cC + dD
выражение для константы равновесия имеет вид:
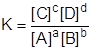 . .
| (14) |
Константа равновесия представляет собой отношение произведения молярных концентраций продуктов реакций к произведению молярных концентраций исходных веществ с учетом стехиометрических коэффициентов. Константа равновесия является главной характеристикой процесса равновесия. Ее величина зависит от температуры и природы реагирующих веществ и определяет глубину протекания процесса к моменту достижения равновесного состояния. Чем больше константа равновесия, тем больше равновесие сдвинуто в сторону образования продуктов прямой реакции.
Для химических реакций, протекающих с участием газообразных веществ, константу химического равновесия можно выразить через парциальные давления компонентов:
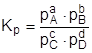 . .
| (15) |
Константа химического равновесия, выраженная через парциальные давления веществ, связана с константой равновесия, выраженной через молярные концентрации, соотношением:
| Kp = K×(R×T)Dn, | (16) |
где Dn – изменение количества молей газообразных веществ в химической реакции: Dn = (c + d) – (a + b), R – универсальная газовая постоянная, T – температура.
Величину константы равновесия можно определить, зная изменение энергии Гиббса в ходе химической реакции (DG) по уравнению:
| DG = - R×T (ln Kp). | (17) |
Для гетерогенных реакций концентрация твердой фазы в выражение для константы равновесия не входит.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 638; Нарушение авторских прав?; Мы поможем в написании вашей работы!