
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Правило фаз Гиббса
|
|
|
|
Пусть имеется система, состоящая из трех фаз (I), (II), (III). Тогда условия равновесия можно записать следующим образом:
1) р(1) = р(11) = р(111) – условие механического равновесия,
2) Т(1) = Т(11) = Т(111) – условие термического равновесия,
mi(1) = mi(11) = mi(111) – условие химического равновесия.
Из анализа этих условий и было получено правило фаз Гиббса, которое обычно формулируют следующим образом:
Число степеней свободы (f) равновесной термодинамической системы, на которую влияют только температура (Т) и давление (р), равно числу независимых компонентов системы (k) минус число фаз (Ф) плюс 2.
Математически правило фаз Гиббса записывается так: f = k – Ф + 2.
Число степеней свободы – это число независимых переменных, которые можно изменять произвольно в некоторых пределах так, чтобы число и природа фаз остались прежними.
Число степеней свободы характеризует вариантность системы, которая в зависимости от величины f может быть следующей:
1) нонвариантная система (безвариантная, f = 0),
2) моновариантная система (одновариантная, f = 1),
3) бивариантная система (двухвариантная, f = 2) и т.д.
На практике часто рассматривают влияние только одного переменного внешнего параметра на систему (т.е. берут или постоянное давление (тогда Т¹const), или постоянную температуру (тогда p¹const)). В этом случае n=1 и правило фаз Гиббса имеет вид:
f = k – Ф + 1. (единица относится к переменному внешнему параметру).
Пример 4.3 Определить число компонентов в системах:
a) Н2(г) + I2(г) = 2НI(г),
б) СaCO3(тв) = СaO(тв) + СO2(г).
Решение. a) В этой системе имеется одно уравнение, связывающее концентрации состовляющих частей:
H2(г) + I2(г) = 2HI(г)
 ,
,
следовательно, число компонентов в этой системе равно: 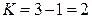 .
.
|
|
|
б) В этой системе также имеется только одно уравнение:
CaCO3(тв) → СaO(тв) + СO2(г)
 ,
,
следовательно, система будет двухкомпонентной, поскольку
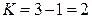 .
.
4.3 Уравнение Клапейрона–Клаузиуса
Ограничимся рассмотрением фазовых переходов первого рода, для которых характерно равенство изобарно-изотермических потенциалов двух фаз и скачкообразное изменение энтропии S и объёма V.
Будем рассматривать равновесие чистого вещества в двух фазах однокомпонентной системы (k = 1). Это могут быть следующие процессы:
а) Атв 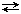 Аж – это процесс плавления (обратный процесс – кристаллизация);
Аж – это процесс плавления (обратный процесс – кристаллизация);
б) Аж 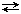 Агаз – процесс испарения (обратный процесс – конденсация);
Агаз – процесс испарения (обратный процесс – конденсация);
в) Атв 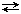 Агаз – процесс сублимации (возгонки), (обратный процесс – десублимация или конденсация);
Агаз – процесс сублимации (возгонки), (обратный процесс – десублимация или конденсация);
г) Атв,a 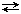 Атв,b – переход твердого тела из одной полиморфной (аллотропной) модификации в другую.
Атв,b – переход твердого тела из одной полиморфной (аллотропной) модификации в другую.
Для равновесия двух фаз (1) и (2) чистого вещества должны выполняться следующие условия:
р(1) = р(2); (1)
Т(1) = Т(2); (2)
m(1) = m(2); (3)
Из соотношения (3)получим, что dm(1) = dm(2) (4)
Но для чистого вещества химический потенциал m есть ни что иное, как молярная энергия Гиббса:  .
.
Поэтому  .
.
Но  .
.
Для двух фаз (1) и (2) соотношение (4) примет вид:
 (5)
(5)
Перегруппируем члены:
 , откуда
, откуда
 .
.
Таким образом, получаем:
 (6)
(6)
Соотношения (6) – это одна из форм записи уравнения Клапейрона-Клаузиуса.
Здесь DSф.п. – молярная энтропия фазового перехода (т.е. разность молярных энтропий вещества в двух фазах);
DVф.п. – разность молярных объемов вещества в двух фазах.
Если рассматривать обратимые изотермические фазовые переходы, то для них
 .
.
Тогда уравнения (6) можно переписать в следующем виде:
 (7)
(7)
Соотношение (7) – это тоже уравнение Клапейрона–Клаузиуса. Здесь Т – температура фазового перехода, DНф.п. – молярная теплота (энтальпия)
фазового перехода. Величину  часто называют температурным коэффициентом давления насыщенного пара. Величина
часто называют температурным коэффициентом давления насыщенного пара. Величина  является угловым коэффициентом соответствующих кривых р = р(Т) (сублимации, испарения, плавления и полиморфных превращений).
является угловым коэффициентом соответствующих кривых р = р(Т) (сублимации, испарения, плавления и полиморфных превращений).
|
|
|
Рассмотрим вначале равновесия с участием пара.
а) твердое вещество 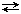 пар – возгонка (сублимация);
пар – возгонка (сублимация);
б) жидкость 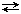 пар – испарение (конденсация).
пар – испарение (конденсация).
Если рассматривать равновесия в области температур, далеких от критической, то можно записать:
 ;
;
 ,
,
поскольку объемом конденсированной фазы по сравнению с объемом пара можно пренебречь. Считая, что пар подчиняется законам идеальных газов
для 1 моль газа имеем:
 и
и  ,
,
тогда 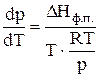
откуда следует, что  (8)
(8)
Соотношение (8)–дифференциальная форма уравнения Клапейрона-Клаузиуса для процессов возгонки или испарения.
Так как DHвозг > 0 и DHисп > 0, то lnp (а, значит, и р) – возрастающая функция, т.е. давление насыщенного пара над веществом увеличивается при увеличении температуры.
Разделим переменные в соотношении (8) Считаем, что в узком температурном интервале DHф.п. = const.
1) Возьмем неопределенный интеграл:

Отсюда:
 или
или  (9)
(9)
Уравнение прямой в координатах ln p-1/Т.
DНвозг > DНиспар,
Поэтому кривая возгонки р = р(Т) должна идти круче, чем кривая испарения. Если на одном графике изобразить зависимости в координатах lnp=f ( ), то будет наблюдаться следующая картина:
), то будет наблюдаться следующая картина:
Линия АВ - соответствует процессу испарения, а линия ВС - процессу возгонки.
2) Возьмем определенный интеграл:
 (10)
(10)
 |
Рассмотрим теперь процесс плавления:
Воспользуемся уравнением Клапейрона-Клаузиуса в виде:
 (11)
(11)
Здесь Т – температура плавления;
 ; DНплавл – молярная теплота плавления.
; DНплавл – молярная теплота плавления.
Знак производной  зависит от знака DVплавл. Обычно
зависит от знака DVплавл. Обычно  , поэтому
, поэтому
DVплавл > 0. Есть несколько исключений (например, вода, висмут, галлий для которых DVплавл < 0).
Температура фазового перехода между конденсированными фазами слабо зависит от давления р, поэтому соотношение (11) можно переписать в виде:

Пример 4.4 Как изменится температура плавления льда с изменением внешнего давления, если Δпл Н = 79,7 кал/г при t = 0 оС, а удельные объемы воды и льда при этой температуре равны соответственно: V ж = 1,0001 см3/г и V лед = 1,0908 см3/г.
Решение. Воспользуемся уравнением Клаузиуса – Клапейрона в виде (4.16)
 .
.

 ,
,
 .
.
Пример 4.5 Как изменится температура кипения воды с ростом давления, если при температуре t = 100 оС Δисп Н = 539,7 кал/г, V пар = 1651 см3/г, V ж = 1 см3/г.
|
|
|
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 547; Нарушение авторских прав?; Мы поможем в написании вашей работы!