
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Шеин, А.Б
|
|
|
|
Химическая кинетика, электрохимия
ЧАСТЬ II
Курс лекций
ФИЗИЧЕСКАЯ ХИМИЯ
А.Б.Шеин, М.А.Виноградова
Человек и свобода. Человек и любовь.
Сущность и существование.
Целостность человека.
Рациональный и иррациональный компонент.
Бессознательное.
Подсознательное,
Человек и его фундаментальные качества.
Теоцентризм, природоцентризм, антропоцентризм, социоцентризм и их взаимосвязь.
Проблема происхождения человека:
- религиозная,
- эволюционная (трудовая),
- аномальная,
- космическая концепции и их взаимосвязь.
1863 Т.Гексли «Место человека в природе»
1871 Ч.Дарвин «Происхождение человека и половой отбор»
1903 И.Мечников «Этюды о природе человека».
Человек как духовно-душевно-телесное существо.
Сущность человека – во взаимосвязи трех компонент:
- биологической- телесность, анатомо-физиологические задатки, тип нервной системы, половые и возрастные особенности, состояние здоровья.
- психологической- ум, чувства, воля, внимание, память, воображение, мотивы, установки, потребности, характер.
- Социальной- мировоззрение, моральные принципы, система ценностей, социальный опыт(умения, знания, навыки).
Сущность человека и его потребности.
Концепция базовых потребностей А.Маслоу:
1. Базисные потребности:
- физиологические,
- экзистенциальные
2. Приобретенные:
- социальные,
- престижные,
- творческие.
Психика человека:
сознание,
Не все в человеке собственно человеческое. Человек –возможность стать человеком. Это – свобода выбора. Человек принципиально незавершен.
Жизнь и смерть в духовном опыте человека. («Жизнь человека –не что иное, как подготовка к смерти» - А.Шопенгауэр).
|
|
|
Биоэтика – комплексная дисциплина, находящаяся на стыке философии, этики, биологии, медицины. Появилась в 60-е годы. XX века как реакция на новые проблемы жизни и смерти, угрозы для жизни на земле. В биоэтике рассматриваются проблемы аборта, пересадки органов, новые технологии деторождения, генной инженерии, половой самоидентификации человека, эвтаназии, отношение к психическому здоровью.
ПЕРМЬ 2010
УДК 541
ББК 24.5
Ш 39
Ш39 Физическая химия: курс лекций. Ч. 2: Химическая кинетика, электрохимия: учеб. пособие / А.Б.Шеин, М.А.Виноградова; Перм. гос. ун-т. – Пермь, 2010. – 404 с.: ил.
ISBN
Издание представляет собой курс лекций по физической химии, включающий разделы «Химическая кинетика» и «Электрохимия», читаемый студентам химического факультета Пермского государственного университета.
Подробно излагаются основы формальной кинетики, теория цепных и фотохимических реакций, различные подходы к раскрытию природы каталитических реакций. В разделе «Электрохимия» рассматриваются не только теоретические вопросы данной науки (включая историю развития взглядов на основные проблемы электрохимии), но и практическое применение электрохимических методов в физико-химическом анализе.
Предназначено для студентов 3 курса химического факультета, изучающих дисциплину «Химическая кинетика и электрохимия». Может быть использовано студентами биологического и геологического факультетов при изучении дисциплины «Физическая и коллоидная химия».
Табл. 8. Ил. 42. Библиогр. 16 назв.
Печатается по решению ученого совета химического факультета Пермского государственного университета
Рецензент: д-р хим. наук, проф. А.Е.Леснов (Институт технической химии УрО РАН); кафедра физической и коллоидной химии ГОУ ВПО «Пермская государственная фармацевтическая академия»
УДК 541
ББК 24.5
ISBN Ó Шеин А.Б., Виноградова М.А.,
Ó Пермский государственный
|
|
|
университет, 2010
Раздел IV. Химическая кинетика и катализ
Лекция 30
Скорость химической реакции. Двусторонние и односторонние (обратимые и необратимые) реакции. Молекулярность и порядок реакции. Кинетическая классификация реакций
Химическая кинетика - раздел физической химии, посвящённый закономерностям протекания химических процессов во времени. Одной из задач химической кинетики является количественное описание протекания химических реакций во времени при постоянной температуре в зависимости от концентраций реагирующих веществ. Этот раздел химической кинетики называется формальной кинетикой.
В общем виде химическую реакцию можно записать следующим образом:
n1 А1 + n2 А2 +... + nn An = n1¢A1¢ + n2¢A2¢ +... + nn¢An¢.
Скоростью химической реакции называется количество молекул данного сорта, реагирующих в единицу времени в единице объёма. Для определения скорости химической реакции достаточно знать изменение во времени количества одного из участвующих в реакции веществ (исходного или конечного), так как изменение количества всех остальных веществ можно определить из уравнения реакции.
Химические реакции редко протекают в одну стадию, так как их принято записывать. Запись уравнения реакции можно рассматривать как символическое выражение материального баланса (закона сохранения вещества). В действительности подавляющая часть химических реакций протекает через ряд промежуточных стадий, и в большинстве случаев детальный механизм протекания реакции нам неизвестен из-за больших трудностей выявления промежуточных продуктов. Скорость суммарной реакции определяется скоростью наиболее медленной стадии, которая называется лимитирующей.
Еще в самом начале исследований по химической кинетике было сделано физически очевидное предположение, что реагируют только те молекулы, которые сталкиваются. Как известно, число столкновений прямо пропорционально числу молекул, поэтому скорость реакции должна быть пропорциональна концентрации реагирующих веществ. В общем случае можно принять, что скорость химической реакции прямо пропорциональна концентрациям реагирующих веществ в некоторых степенях:
v = k  , [ v ] = моль/(м3×с) или молекул/(м3×с);
, [ v ] = моль/(м3×с) или молекул/(м3×с);
|
|
|
k - константа скорости химической реакции, k зависит от природы реакции и является функцией температуры;
ni - порядок реакции по данному веществу; в общем случае порядки реакции по веществам никак не связаны со стехиометрическими коэффициентами n i этих веществ в уравнении реакции, и только в тех случаях, когда реакция протекает в одну стадию, порядок реакции ni по данному веществу совпадает со стехиометрическим коэффициентом n i данного вещества в химическом уравнении.
Вышеприведенное выражение называют основным постулатом химической кинетики.
Физический смысл коэффициента k: v = k, если  , то есть константа скорости химической реакции есть скорость реакции при условии, что концентрации реагирующих веществ равны 1; k иногда называют удельной скоростью химической реакции. Размерность константы скорости зависит от порядка реакции.
, то есть константа скорости химической реакции есть скорость реакции при условии, что концентрации реагирующих веществ равны 1; k иногда называют удельной скоростью химической реакции. Размерность константы скорости зависит от порядка реакции.
Скорость реакции является функцией времени, так как количества реагирующих веществ меняются во времени. Введем понятие средней скорости реакции:
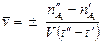 ,
,
 и
и  - число молей одного из веществ в начальный t¢ и конечный t¢¢ моменты времени; V - объем системы. Знак «-» в выражении стоит тогда, когда мы следим за ходом реакции по изменению количества одного из исходных веществ, поскольку в этом случае
- число молей одного из веществ в начальный t¢ и конечный t¢¢ моменты времени; V - объем системы. Знак «-» в выражении стоит тогда, когда мы следим за ходом реакции по изменению количества одного из исходных веществ, поскольку в этом случае  >
>  , а скорость реакции может быть только положительной величиной. Знак «+» используют, если скорость реакции определяют по ее продукту.
, а скорость реакции может быть только положительной величиной. Знак «+» используют, если скорость реакции определяют по ее продукту.
Если t¢¢ - t¢ ® 0, то получим истинную скорость v реакции (скорость реакции в данный момент времени):
v = ±  .
.
Если V = const, то v = ±  .
.
Этим уравнением удобно пользоваться при рассмотрении реакций в растворах, так как изменением объема раствора в результате реакции во многих случаях можно пренебречь.
Для реакций, протекающих в газовой фазе, скорость можно определять также через парциальные давления веществ.
Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и наличия катализатора.
Следует иметь в виду, что при вышеприведенном определении скорости химической реакции (число молекул, реагирующих в единицу времени в единице объема) числовое значение величины скорости реакции будет зависеть от того, какое вещество из участвующих в реакции мы выбрали, чтобы следить за ее скоростью, так как стехиометрические коэффициенты разных участников реакции могут отличаться друг от друга. Например, в реакции синтеза бромоводорода
|
|
|
Н2 + Br2 = 2HBr
за одно и то же время образуется в 2 раза большее число молей HBr, чем прореагирует молей Н2 и Br2 , и, следовательно, скорость реакции, определенная по бромоводороду, будет в 2 раза выше, чем скорость, определенная по водороду либо по брому:
 .
.
Чтобы устранить эту неопределенность, скорость реакции рассчитывают на единицу стехиометрического коэффициента, и тогда ее величина не зависит от того, по какому веществу ее определяют:

В общем виде можно записать

где 
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1084; Нарушение авторских прав?; Мы поможем в написании вашей работы!