
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Двойной электрический слой
|
|
|
|
Строение границы электрод-раствор.
Двойной электрический слой, механизм возникновения и строение
Измерение ЭДС
Для измерения равновесной (обратимой) величины ЭДС электрохимического элемента необходимо, чтобы процесс совершался бесконечно медленно, то есть чтобы элемент работал при бесконечно малой силе тока. Это условие выполняется в компенсационном методе, который основан на том, что элемент включается последовательно против внешней разности потенциалов и последняя выбирается так, чтобы ток в цепи отсутствовал. Тогда внешняя разность потенциалов равна ЭДС цепи.
Пользуясь компенсационным методом, можно непосредственно измерить значение ЭДС, однако это довольно сложная операция, поэтому в лабораторной практике предпочитают сравнивать ЭДС изучаемого элемента с ЭДС так называемых стандартных (нормальных) элементов, которая тщательно измерена при разных температурах. Этот сравнительный метод также является компенсационным.
Основным нормальным элементом является насыщенный элемент Вестона.
Лекция 54
При соприкосновении проводника первого рода с электролитом на границе электрод – раствор возникает двойной электрический слой. В качестве примера рассмотрим медный электрод, погруженный в раствор CuSO4. Химический потенциал ионов меди в металле при данной Т можно считать постоянным, тогда как химический потенциал ионов меди в растворе зависит от концентрации соли; в общем случае эти химические потенциалы неодинаковы.
Пусть концентрация CuSO4 такова, что 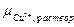 >
> 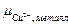 . Тогда при погружении металла в раствор часть ионов Cu2+ из раствора дегидратируется и перейдет на металл, создав на нем положительный заряд. Этот заряд будет препятствовать дальнейшему переходу ионов Cu2+ из раствора на металл и приведет к образованию вблизи электрода слоя притянутых к нему анионов SO42–. Установится так называемое электрохимическое равновесие, при котором химические потенциалы ионов в металле и в растворе будут отличаться на величину разности потенциалов образующегося при этом двойного электрического слоя (ДЭС):
. Тогда при погружении металла в раствор часть ионов Cu2+ из раствора дегидратируется и перейдет на металл, создав на нем положительный заряд. Этот заряд будет препятствовать дальнейшему переходу ионов Cu2+ из раствора на металл и приведет к образованию вблизи электрода слоя притянутых к нему анионов SO42–. Установится так называемое электрохимическое равновесие, при котором химические потенциалы ионов в металле и в растворе будут отличаться на величину разности потенциалов образующегося при этом двойного электрического слоя (ДЭС):
|
|
|
2Fj = 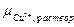 -
- 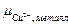 .
.
Разность электрических потенциалов и разность химических потенциалов скомпенсированы при электрохимическом равновесии.
Пусть концентрация CuSO4 настолько мала, что 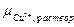 <
< 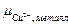 . В этом случае при погружении металла в раствор будет наблюдаться обратный процесс перехода ионов меди из кристаллической решетки металла в раствор и электрод окажется заряженным отрицательно. Этот заряд будет препятствовать дальнейшему переходу ионов Cu2+ в раствор, установится новое электрохимическое равновесие.
. В этом случае при погружении металла в раствор будет наблюдаться обратный процесс перехода ионов меди из кристаллической решетки металла в раствор и электрод окажется заряженным отрицательно. Этот заряд будет препятствовать дальнейшему переходу ионов Cu2+ в раствор, установится новое электрохимическое равновесие.
Можно выбрать такую концентрацию электролита, при которой химические потенциалы ионов в металле и растворе одинаковы. Растворы такой концентрации получили название нулевых растворов. При погружении металла в его нулевой раствор на поверхности электрода не возникает ДЭС, однако и в этом случае разность потенциалов между металлом и раствором не равна нулю.
Согласно Нернсту, единственным источником ЭДС электрохимического элемента является ДЭС на поверхности электродов. Потенциал металлов в нулевом растворе Нернст определял как абсолютный нуль потенциалов. В работах А.Н.Фрумкина было показано, что представления Нернста являются неверными. Экспериментально установлено, что ЭДС элемента, составленного из двух различных электродов, погруженных в свои нулевые растворы, весьма значительно отличается от нуля (может быть более 1 В). Потенциал металла в нулевом растворе, получивший название потенциала нулевого заряда, нельзя рассматривать как абсолютный нуль потенциалов.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 671; Нарушение авторских прав?; Мы поможем в написании вашей работы!