
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Влияние природы и состава раствора
|
|
|
|
а) Влияние растворителя. Наибольшее число исследований по перенапряжению водорода выполнено с водными растворами. Для ртути и для некоторых других металлов были получены данные также и в неводных растворах кислот. Характер изменения h с изменением растворителя точно не установлен. Перенапряжение выделения водорода на ртути из раствора HCl в этиловом и метиловом спиртах ниже, чем из водных растворов; для Cu и Ni в спиртовых растворах оно выше, чем в водных. Для металлов с низким h природа растворителя играет меньшую роль.
б) Влияние рН раствора на перенапряжение водорода с наибольшей полнотой изучено на ртути. Установлено, что в растворах чистых кислот в области концентраций до 0,1н h не является функцией рН; при более высоких концентрациях h зависит от рН, уменьшаясь с увеличением концентрации кислоты, причем Dh/DрН составляет примерно 60 мВ. Если растворы кроме кислоты содержат также избыток постороннего электролита, то подобное изменение h с рН наблюдается и для концентраций кислоты, меньших 0,1н. При избытке постороннего электролита такой ход h с рН наблюдается и для разбавленных растворов щелочей. Таким образом, максимальное перенапряжение водорода соответствует нейтральным растворам и линейно уменьшается с отклонением рН в ту или иную сторону от точки нейтральности. В концентрированных растворах кислот и оснований соотношение между h и составом раствора становится более сложным.
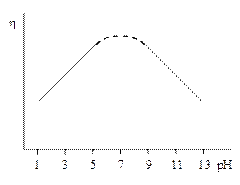
| Рис. 36. Зависимость перенапряжения выделения водорода от рН в растворах с постоянной ионной силой; i = const |
Для других металлов: на Ni h изменяется с рН незначительно и не подчиняется простой линейной зависимости; на Pd и Pt оно почти не зависит от рН раствора.
|
|
|
в) перенапряжение водорода очень чувствительно к присутствию в электролите посторонних веществ. Добавки солей к разбавленным растворам кислот увеличивают h на ртути, причем увеличение концентрации 1-1 зарядного электролита в 10 раз (при постоянном рН) повышает h примерно на 55-58 мВ. Первоначальная добавка электролита с поливалентным катионом оказывает большее действие, чем такая же добавка 1-1 зарядного электролита. Поверхностно-активные вещества (анионы, катионы и молекулярные вещества) или повышают, или понижают h на ртути, в зависимости от их природы. ПАВ сильнее всего влияют на величину h в области малых плотностей тока; действие этих добавок ослабляется с ростом плотности тока и при высоких ее значениях полностью исчезает. На Pt, Fe и Ni h также возрастает при введении ПАВ; характер влияния ПАВ на h и на этих металлах является функцией потенциала электрода.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 345; Нарушение авторских прав?; Мы поможем в написании вашей работы!