
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролиз
|
|
|
|
Электролиз – это окислительно-восстановительный процесс, протекающий под действием постоянного электрического тока в расплаве или растворе электролита. Электрод, на котором протекает процесс восстановления, называется катодом, а электрод, на котором протекает процесс окисления, называется анодом. При рассмотрении катодных процессов материал электрода не имеет значения. Аноды могут быть двух типов. Активный или растворимый анод изготовляется из неблагородного металла, и, как правило, сам окисляется:
Me0 – z ® Mez+.
® Mez+.
Если материал анода не принимает участие в электродной реакции, то он называется инертным. Это могут быть угольные или платиновые электроды.
Как правило, электролиз – это сложный комплекс одновременно протекающих химических и электродных реакций, мы же ограничимся рассмотрением электролиза с угольными электродами водных растворов сильных электролитов. В этих случаях характер электродных процессов зависит только от природы ионов, на которые диссоциируют электролиты.
Уравнение диссоциации сильного электролита в водном растворе:
КхАy«xKy++yAx–, где К– катион, А– анион.
Рассмотрим порядок восстановления катионов:
Если стандартный потенциал металла
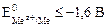
Уравнение катодного процесса:
2Н2О+2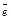 ®Н2+2ОН–.
®Н2+2ОН–.
На катоде восстанавливаются только ионы водорода молекул воды.
Если стандартный потенциал металла 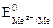 лежит в пределах
лежит в пределах
-1,6<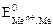 <0 В,
<0 В,
то на катоде одновременно протекают процессы:
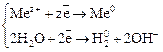
Если стандартный потенциал металла 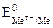 >0 В, то на катоде восстанавливаются только ионы металла:
>0 В, то на катоде восстанавливаются только ионы металла:
Меz++z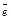 ®Ме0.
®Ме0.
При электролизе сильных кислот уравнение катодного процесса имеет вид:
2Н++2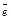 ®Н2
®Н2
Рассмотрим порядок окисления анионов:
|
|
|
1. При электролизе растворов бескислородных кислот и их солей анионы и их солей: галогенид-ионы – Cl¯, Br¯, I¯ (кроме F¯) и сульфид ион S2- окисляются по схеме:
 2Г––2
2Г––2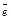 ®Г2
®Г2
S2––2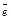 ®S0
®S0
2. При электролизе растворов оснований гидроксид-ионы окисляются по схеме:
4OH––4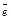 ®O2+2Н2О
®O2+2Н2О
3. При электролизе растворов, высших кислородных кислот и растворов содержащих фторид-ионы, уравнение анодного процесса имеет вид:
2Н2О–4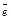 ®O2+4Н+.
®O2+4Н+.
Массу или объем (для газов) образовавшихся при электролизе вещества можно определить по закону Фарадея:
g=Э·I·t/F, V=VЭ·I·t/F.
где Э– эквивалентная масса вещества, г/моль;
VЭ– эквивалентный объем газа л/моль;
F– постоянная Фарадея (F=96494 A·c/моль);
I– сила тока, А;
t– время электролиза, с.
[1] Индекс 1 относится к исходному раствору (до разбавления), индекс 2 - к конечному раствору (после разбавления).
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 223; Нарушение авторских прав?; Мы поможем в написании вашей работы!