
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Атом. Молекула. Химическая связь
|
|
|
|
ТЕМА 1: Структура материалов
ЧАСТЬ 1. «Материаловедение. Технология конструкционных
материалов”
СОДЕРЖАНИЕ:
Понятие структуры………………………….………………………
Атом, молекула, химическая связь ……………………………….
Фазовое состояние вещества ……………………………………..
Газ и жидкость ……………………………………………………..
Твердое вещество……………………………………………….…..
Техническая значимость материалов зависит от строения и выражается в их свойствах. Строение материалов характеризует их структура.
Структура –совокупность устойчивых связей материала, обеспечивающих его целостность и сохранение основных свойств при внешних и внутренних изменениях.
Структура материалов определяется множеством факторов: строением атомов, ионов, молекул, распределением в них электронов, типом связей между частицами и т.д. В материаловедении принято рассматривать три уровня строения материалов: атом–молекула–фаза.
Всякое вещество не является чем-то сплошным, а состоит из отдельных очень маленьких частиц. Различия между веществами обусловлены различием между их частицами: частицы одного вещества одинаковы, частицы различных веществ различны. При всех условиях частицы вещества находятся в движении и чем выше температура тела, тем интенсивнее это движение.
Для большинства веществ частицы представляют собой молекулы. Молекулы в свою очередь состоят из атомов.
Молекула – наименьшая частица вещества, обладающая его химическими свойствами.
Атом –наименьшая частица химического элемента, обладающая его химическими свойствами.
Атом представляет собой систему, состоящую из положительно заряженного ядра, вокруг которого вращаются отрицательно заряженные электроны. Электроны притягивается к ядру и отталкиваются друг от друга. Расположенные ближе к ядру электроны подвержены большему притяжению; они ослабляют притяжение внешних электронов, которые находятся на большем расстоянии от ядра. Внешние электроны могут оторваться от одного атома и присоединяться к другому атому, изменяя число его внешних электронов. Такие электроны называются валентными.
|
|
|
В состав молекулы может входить различное число атомов. При этом атомы могут соединяться друг с другом не только в различных соотношениях, но и различным образом. Поэтому при сравнительно небольшом числе химических элементов число различных веществ очень велико.
Атом, вступив во взаимодействие с атомами другого простого вещества, нарушает своё стабильное строение и утрачивает химические свойства исходного простого вещества. Он образует с другими атомами молекулу нового химического вещества с новым комплексом химических и физических свойств. Молекулы сложных веществ состоят из различных атомов, вступивших в химическое взаимодействие, например 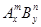 , где верхние индексы означают номер группы Периодической системы элементов, а нижние – число атомов этого элемента в соединении. Молекулы простых веществ состоят из одинаковых атомов, также взаимодействующих между собой
, где верхние индексы означают номер группы Периодической системы элементов, а нижние – число атомов этого элемента в соединении. Молекулы простых веществ состоят из одинаковых атомов, также взаимодействующих между собой 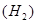 .
.
К таким простым веществам относятся инертные газы и металлы.
В веществах, имеющих ионное или атомное строение, носителем химических свойств является не молекулы, а те комбинации ионов и атомов, которые образуют данное вещество.
Атом представляет собой сложную систему из отрицательно заряженных электронов и положительно заряженного ядра. Благодаря взаимодействию электрических полей, создаваемых электронами и ядрами атомов, участвующих в образовании молекулы или кристалла, возникает химическая связь, которая может быть ковалентной, ионной, металлической, молекулярной. Силы притяжения возникают благодаря взаимодействию электронов с положит. заряж. ядром собственного атома, а также с положит. заряж. ядрами состедних атомов. Силы отталкивания образуются в результате взаимодействия положит зараж ядер соседних атомов при их сближении Они проявляются при сильном сближении и растут интенсивнее, чем силы притяжения.
|
|
|
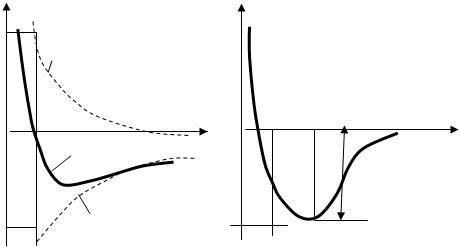 F
F
F
Отталкивание
d0
Результирующая сила
ЕСВ
Притяжение d0
- F
(а) (б)
Рис. Изменение силы взаимодействия (а) и энергии связи (б) при сближении атомов в кристалле
Уравновешивание сил происходит при сближении частиц на расстояние d0.Этому сближению соотвествует минимум энергии связи Есв, что делает кристалл термодинамически стабильным Энергия связи для различных кристаллов приведена в таблице
| Кристалл | Ar | CH4 | Алмаз | SiC | LiF | NaCl | Fe | Na |
| Энергия кДж/моль | 7,5 | |||||||
| Тип связи | Молек. | Молек. | Ковал. | Ковал. | Ионная | Ионная | Метал. | Метал. |
Она определяет температуру плавления, модуль упругости, температурный коэффициент линейного расширения и др.
Ковалентная химическая связь образуется двумя электронами, причем эта электронная пара принадлежит двум атомам. Кристаллы, в котопрых преобладает ковал. Тип связи,называют ковалентными.Их образуют элементы IV,V,VI подгруппы В Период.табл.Мендел.:углерод, кремний,германий,сурьма, висмут и др. При взамиодействии атомы обобществляют свои валентные электроны с соседними атомами, достраивая таким образом валентную зону. Каждая связь образуется парой электронов, движущихся по замкнутым орбитам между двумя атомами. Число атомов n, c которыми происходит обобщ.электронов,зависит от валентности элемента и определ.по форм.
n= 8-N,
где N- валентность элементов.
Например, для углерода это число n=4, т.е. атом углерода имеет четыре валентных электрона, посредством которых он образует четыре направленные связи и вступает в обменное взаимодействие с четырьмя соседними атомами.
Образование химической связи между атомами является результатом взаимопроникновения («перекрывания») электронных облаков, происходящего при сближении взаимодействующих атомов. Вследствие такого взаимопроникновения плотность отрицательного электрического заряда в межъядерном пространстве возрастает. Положительно заряженные ядра атомов притягиваются к области перекрывания электронных облаков, что и приводит к образованию устойчивой молекулы.
|
|
|
Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
Если двухатомная молекула состоит из атомов одного элемента (например, молекулы 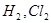 и т.п.), то каждое электронное облако, образованное общей парой электронов и осуществляющее ковалентную связь, распределяется в пространстве симметрично относительно обоих атомов. В подобном случае ковалентная связь называется неполярной. Если двухатомная молекула состоит из атомов различных элементов, то общее электронное облако смещено в сторону одного из атомов, так что возникает ассиметрия в распределении заряда. В таких случаях ковалентная связь называется полярной.
и т.п.), то каждое электронное облако, образованное общей парой электронов и осуществляющее ковалентную связь, распределяется в пространстве симметрично относительно обоих атомов. В подобном случае ковалентная связь называется неполярной. Если двухатомная молекула состоит из атомов различных элементов, то общее электронное облако смещено в сторону одного из атомов, так что возникает ассиметрия в распределении заряда. В таких случаях ковалентная связь называется полярной.
Например, в молекуле HCl общая электронная пара смещена в сторону атома хлора. Следовательно, молекула хлористого водорода является полярной молекулой.
Полярность молекул оказывает заметное влияние на свойства образуемых ими веществ. Вещества, образованные полярными молекулами, обладают, как правило, более высокими температурами плавления и кипения, чем вещества из неполярных молекул.
Ионная связь –осуществляется в результате взаимного электростатического притяжения противоположно заряженных ионов.
Во время химических реакций атомы присоединяют электроны атомов других элементов или отдают электроны другим атомам.
Атомы, отдавшие часть электронов приобретают положительный заряд и становятся положительно заряженными ионами. Атомы, присоединившие электроны, превращаются в отрицательно заряженные ионы. Разноимённо заряженные ионы удерживаются друг около друга силами электростатического притяжения.
Два разноименных иона, притянувшихся друг к другу, сохраняют способность электростатически взаимодействовать с другими ионами. Данный ион может координировать вокруг себя еще некоторое число ионов противоположного знака. Ионные молекулы способны соединяться друг с другом.
|
|
|
Вещества с ионной связью в молекуле характеризуются высокими температурами плавления и кипения.
Металлическая связь –это связь, в которой электроны каждого отдельного атома принадлежат всем атомам, находящимися в контакте. При этом валентные электроны способны свободно перемещаться в объеме кристалла. Металлическая связь характерна для металлов, их сплавов и интерметаллических соединений.
Металлическое состояние возникает в комплексе атомов, когда при их сближении внешние электроны теряют связь с отдельными атомами, становятся общими, т.е. коллективизируются и свободно перемещаются между положительно заряженными и периодически расположенными ионами.
Устойчивость металла, представляющего собой, таким образом, ионно-электронную систему, определяется электрическим притяжением между положительно заряженными ионами и обобщенными электронами.
Сила связи в металлах определяется силами отталкивания и силами притяжения между ионами и электронами и не имеет резко выраженного направленного характера. Атомы в металле располагаются закономерно, образуя правильную кристаллическую решетку, что соответствует минимальной энергии взаимодействия атомов.
Металлическая связь ненапрвленная. Следствием этого является высокое координационное число и большая компактность кристаллических структур металлов.
Среди металлических кристаллов распространено явление полиморфизма – способность в твердом состоянии при различных температурах (или давлении) иметь различные типы кристаллических структур. Эти кристаллические структуры называют аллотропическими формами, или модификациями. Низкоиемпратурную модификацию обозначают a, а высокотемпературную - b,g,d и т.д.
Специфическими свойствами металлической связи объясняются характерные свойства металлов. Высокая электропроводность металлов объясняется присутствием в них свободных электронов. Которые перемещаются в потенциальном поле решетки. С повышением температуры усиливаются колебания атомов (ионов), что затрудняет движение электронов, в результате чего электросопротивление возрастает. При низких температурах колебательное движение ионов (атомов) сильно уменьшается и электропроводность возрастает.
Высокая пластичность металлов объясняется периодичностью их атомной структуры и отсутствием направленности металлической связи. При механическом воздействии на твердое тело отдельные слои его кристаллической решетки смещаются относительно друг друга. В кристаллах с атомной структурой это приводит к разрыву ковалентных связей меджу атомами, принадлежащими к различным слоям, и кристалл разрушается. В кристаллах с ионной структурой при взаимном смещении слоев неизбежно создается такое положение, при котором рядом оказываются одноименно заряженные ионы, при том возникают силы электростатического отталкивания и кристалл разрушается. В случае же металла при смещении отдельных слоев его кристаллической решетки происходит лишь некоторое перераспределение электронного газа, связывающего друг с другом атомы металла, но разрыва химических связей не происходит–металл деформируется не разрушаясь.
Молекулярная связь – самая слабая связь (связь Ван-дер-Ваальса) существует между молекулами в некоторых веществах с ковалентной внутримолекулярной связью. Притяжение между молекулами здесь обеспечивается согласованным движением электронов в соседних молекулах: в любой момент времени электроны максимально удалены друг от друга и максимально приближены к (+) ионам. При этом сила притяжения электронов с (+) ионами выше, чем сила отталкивания между электронами внешних орбит.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 3766; Нарушение авторских прав?; Мы поможем в написании вашей работы!