
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства аммиака
Химические свойства аммиака обусловлены: 1) образованием водородных связей; 2) неподеленной электронной парой.
1. Аммиак хорошо растворим в воде (по растворимости в воде аммиак превосходит любой другой газ). Формулу растворенного аммиака в воде принято записывать NH4OH. Но такого соединения не существует, ни в твердой фазе, ни в водном растворе. Известны твердые гидраты состава 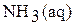
NH3 × Н2О, 2NH3 × Н2О, NH3 × 2Н2О (молекулы аммиака и воды связаны водородными связями), которые устойчивы при низких температурах. Прим. при повышении температуры гидраты разрушаются с образованием аммиака и воды.
Растворы аммиака лучше всего записывать формулой NH3 (aq).
Водные растворы аммиака проявляют свойства слабого основания. Но водные растворы аммиака обладают основными свойствами не за счет образования несуществующего соединения NH4ОН, а вследствие донорной активности атома азота в NH3.
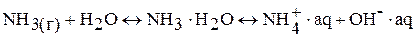
Прим. Связь О – Н более полярная, чем связь N –Н, диссоциация происходит по более полярной связи, Н+ отщепляется от молекулы воды и присоединяется к атому азота (донорно-акцепторный механизм).
Вследствие полярности молекул и высокой диэлектрической проницаемости жидкий аммиак является хорошим неводным растворителем. В неводном растворе аммиак может диссоциировать по типу кислоты:
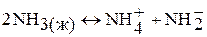
Но собственная диссоциация жидкого аммиака очень мала и ионное произведение аммиака составляет 2,2 × 10-33 при –50 ºС.
Жидкий аммиак – сильно ионизирующий растворитель. Производные NH4+ в жидком аммиаке ведут себя как кислоты (например, сильными кислотами в жидком аммиаке являются NH4Cl, NH4NO3), а производные NH2– – как основания (KNH2, Ba(NH2)2). Производные NH2– – амиды, а производные NH2– – имиды. Примеры реакций в жидком аммиаке:
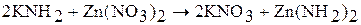 (основание)
(основание)
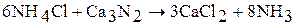 (кислота)
(кислота)
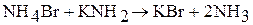 (нейтрализация)
(нейтрализация)
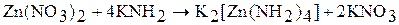 (комплекс)
(комплекс)
2. наличием неподеленной электронной пары (аммиак может выступать в роли донора). Аммиак реагирует с кислотами, с образованием солей аммония:
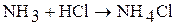
3. Аммиак может образовывать комплексные соединения – аммиакаты:
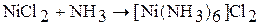
4. В жидком аммиаке растворяются активные металлы – щелочные и щелочноземельные, магний, алюминий. Щелочные металлы реагируют с жидким аммиаком с образованием амида (в присутствии катализатора – платины):
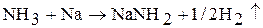
В данной реакции аммиак проявляет свойства окислителя за счет атома водорода. Аналогичная реакция протекает и в газовой фазе. Другие металлы при взаимодействии с газообразным аммиаком образуют нитриды:
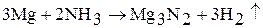
5. Аммиак проявляет восстановительные свойства (за счет атома азота в минимальной степени окисления). На воздухе аммиак не горит, но в атмосфере кислорода сгорает с образованием азота и водяных паров:
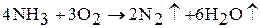
Может происходить каталитическое окисление аммиака:
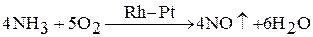
Обе реакции протекают самопроизвольно, так как 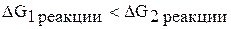 , при горении аммиака образуется свободный азот. В присутствии катализатора (платиновый или платиново-родиевый) протекает вторая реакция с образованием оксида азота (II). Реакция идет при комнатной температуре
, при горении аммиака образуется свободный азот. В присутствии катализатора (платиновый или платиново-родиевый) протекает вторая реакция с образованием оксида азота (II). Реакция идет при комнатной температуре
Прим. в качестве побочного продукта образуется нитрат аммония:
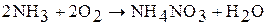
|
|
Дата добавления: 2014-01-15; Просмотров: 1457; Нарушение авторских прав?; Мы поможем в написании вашей работы!