
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механизм химических реакций, протекающих в PECVD реакторах при росте плёнки a-Si:H
|
|
|
|
Лекция 3. Основные химические вещества, используемые в реакторах химического газо-фазного осаждения. Механизмы реакций, протекающих в реакторах PECVD и MOCVD при росте полупроводниковых плёнок.
В MOCVD реакторах используются три типа химических веществ:
1. Металлоорганические вещества, их ещё часто называют алкилами, поскольку в своём составе они содержат алкилы, т.е. одновалентные радикалы насыщенных углеводородов. Например, -СН3 - метил – это радикал метана СН4, -С2Н5 –этил – это радикал этана С2Н6.
2. Гидриды, т.е. химические соединения элемента с водородом, например: РH3 –гидрид фосфора (фосфин).
3. Легирующие вещества (dopants), которые добавляются в небольших количествах к тому или иному полупроводнику, чтобы изменить его проводимость. Бывают n- (электронные) и p- (дырочные) легирующие вещества. Легирующими веществами могут быть как алкилы, так и гидриды, а иногда и галогениды, например СBr4.
К первой группе веществ следует отнести следующие:
1) Триметилалюминий (М.М.=72,09), химическая формула Аl(CH3)3 или часто пишут TMAl (пространственный вид молекулы приведён на рисунке ниже, слева), температура плавления +15,4оС, температура кипения +127оС (при комнатной температуре 295К – это бесцветная жидкость), плотность при 20оС ~0,752 г/мл, зависимость парциального давления от температуры описывается формулой:
log10P(mm Hg) = 8,22 – 2134/T(K) (на рисунке ниже, справа представлена кривая зависимости давления паров от температуры, построенная по приведённой формуле);

2) Триметилгаллий (М.М.=114,82), химическая формула Ga(CН3)3 или TMGa (пространственный вид молекулы приведён на рисунке внизу, слева), температура плавления –15,8оС, температура кипения 55,7оС (при комнатной температуре – это бесцветная жидкость), плотность при 20оС ~1,151 г/мл, температурная зависимость парциального давления описывается формулой:
|
|
|
log10P(mm Hg) = 8,070 – 1703/T(K) (график зависимости давления паров от температуры представлен ниже, справа);

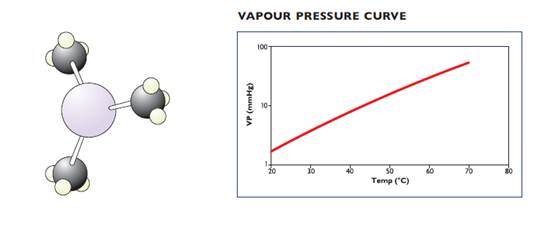
3) Триметилиндий (М.М.=159,93), химическая формула In(CH3)3 или TMIn (структура молекулы представлена на рисунке ниже, слева), температура плавления +88,4оС, температура кипения 133,8оС (при комнатной температуре - это белый кристаллический порошок), плотность при 20оС ~1,568 г/мл, температурная зависимость парциального давления описывается уравнением:
log10P(mm Hg) = 10,52 – 3014/T(K) (ниже, справа представлена кривая давление паров от температуры);
Ко второй группе относятся:
1) Арсин (М.М.=77,95), химическая формула AsH3 или гидрид мышьяка (структура молекулы представлена ниже, слева), температура кипения -62,5оС, температура кристаллизации -117оС (при комнатной температуре – это бесцветный газ), плотность при 15оС ~3,29 г/л. Арсин в газовом баллоне находится в сжиженном состоянии (критическая температура Тkр =101,5оС), зависимость давления паров от температуры описывается уравнением:
log10P(mm Hg) = 6,569-762,4/T(K),
т.е. при комнатной температуре 295К давление пара в баллоне будет 9961 Торр или 13,1 атм (кривая зависимости давления паров от температуры дана ниже, слева).
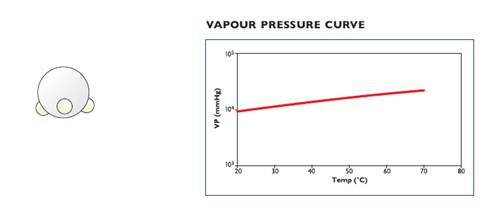
2) Фосфин (М.М.=34,0), химическая формула PH3 или гидрид фосфора (структура молекулы представлена на рисунке ниже, слева), температура кипения -87оС, температура плавления – 134оС (при комнатной температуре – это бесцветный газ), плотность при 15оС ~ 1,45 г/л. Фосфин в газовом баллоне также находится в сжиженном состоянии (Тkр = 52,4оС), зависимость давления паров от температуры описывается уравнением:
log10P(mm Hg) = 6,984-754,1/T(K),
т.е. при комнатной температуре 295 К давление пара в баллоне будет 26792 Торр или 35,3 атм (кривая зависимости давления паров от температуры дана ниже, слева).
|
|
|

К третьей группе, т.е. легирующим материалам относятся как отдельные алкилы, содержащие в своём составе металлы II и VI групп периодической системы, так и гидриды:
1) Диметилцинк (М.М.=95,44), химическая формула Zn (CH3)2 или DMZn, температура плавления -42оС, температура кипения +46оС, при комнатной температуре – это бесцветная жидкость, плотность при 10оС ~1,386 г/мл, зависимость давления паров от температуры описывается уравнением:
log10P(mm Hg) = 7,8-1560/Т(К), (ниже, справа представлена кривая зависимости давления пара от температуры).

2) Диэтилтеллур (М.М.=185,68), химическая формула Te (C2H5)2 или DETe (структура молекулы дана ниже), точка кипения +137оС, при комнатной температуре – это янтарная жидкость, плотность при 20оС ~ 1,599 г/мл, зависимость давления паров от температуры описывается уравнением:
log10P(mm Hg) = 7,99-2093/T(K), (зависимость давления пара от температуры см. ниже).

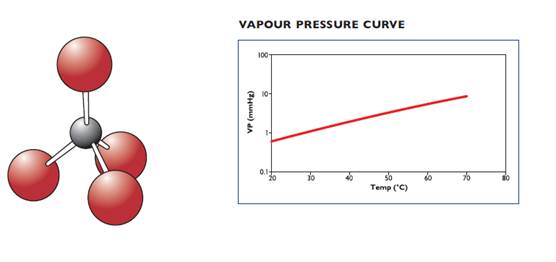
3) Газовая смесь – дисилан (200 ppm) в водороде, химическая формула Si2H6, в баллоне – это газообразная смесь,
4) Тетрабромид углерода, химическая формула CBr4 (М.М.=331,6). Это вещество не относится ни к алкилам, ни к гидридам, это галогенид углерода. Температура плавления +88-90оС, температура кипения +190оС (при комнатной температуре – это белый кристаллический порошок), плотность при 20оC ~3,42 г/мл. Температурная зависимость парциального давления описывается уравнением (графическое изображение – см. ниже, справа):
log10P(mm Hg) = 7,780 – 2346/T(K).
Для лучшего понимания химических реакций, протекающих в реакторах CVD, рассмотрим электронную структуру элементов, входящих в соединения A3B5. Сначала рассмотрим элементы III группы: алюминий Al, галлий Ga и индий In. Все эти элементы типичные металлы. Алюминий (порядковый номер Z=13 в периодической системе элементов) имеет электронной строение, которое можно представить общей формулой 1s22s22p63s23p1. Здесь s и p – энергетические подуровни. Галлий (порядковый номер Z=31) имеет уже более сложное электронное строение: 1s22s22p63s23p63d104s24p1. Если рассмотреть только внешний электронный слой элементов Al, Ga и In, то легко увидеть, что он очень похож (алюминий - 3s23p1, галлий – 4s24p1 и In – 5s25p1) Т.е. внешний электронный слой Al,Ga,In можно записать общей формулой ns2np1. Заметим, что n здесь совпадает c номером периода элемента в периодической системе.
|
|
|
Если представим этот обобщённый внешний электронный слой ns2np1 с помощью графической схемы «квантовых ячеек», то получим:
Невозбуждённое состояние Возбуждённое состояние
 | 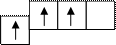 |
Таким образом, можно заключить, что на внешней электронной оболочке этих трёх элементов (Al, Ga, In) находятся по три электрона, которые эти элементы готовы отдать (потенциал первичной ионизации Al составляет только 5,98 В) и превратиться в положительные трёхзаряженные ионы Al+3, Ga+3, In+3.
По аналогии с элементами III группы рассмотрим элементы V группы: азот N, фосфор P, мышьяк As. Фосфор и мышьяк являются типичными неметаллами. Обобщённый внешний электронный слой этих трёх элементов можно представить в виде: ns2np3. Т.е. на подуровне р у этих элементов имеется по 3 неспаренных электрона (cм. схему ниже)
Невозбуждённое состояние








и элементы (N, P, As) стремятся приобрести (потенциал первичной ионизации азота составляет 14,53 В в отличие от металлов) по 3 электрона, чтобы образовать полностью заполненную р-оболочку ns2np6.
При образовании соединения А3В5 атом металла отдаёт свои три электрона на образование ковалентных (гомеополярных) связей с атомом неметалла, кроме того два электрона с оболочки s становятся общими для атома металла и неметалла, так образуется четвёртая связь. Изучение соединений А3В5 на примере GaN, GaP, GaAs показало, что все четыре связи между атомами совершенно равноценны, имеет место, так называемая sp3-гибридизация. Каждый атом металла находится в вершине правильного тетраэдра и соединён с четырьмя атомами неметалла (и наоборот). Т.е. для арсенида галлия правильно будет записать формулу Ga+4As-4.
В общем случае при газофазной химической реакции в MOCVD реакторе элементы Al, Ga, In будут взаимодействовать с элементами N, P, As с образованием стабильных кристаллических бинарных соединений типа GaAs, GaN и т.д.
Брутто реакцию, протекающую в MOCVD реакторе при выращивании плёнки GaAs можно записать в виде:
t >650oC
|
|
|
Ga(CH3)3 + AsH3 → GaAs + 3 CH4.
Уместно заметить, что в настоящее время реакторы MOCVD часто используют для выращивания не столько бинарных кристаллических соединений типа GaAs или GaN, сколько тройных и даже четверных. Например, реакцию, протекающую в реакторе при выращивании пленки InxGa1-xAs можно записать в виде:
t >650oC
[1-x{Ga(CH3)3}] + x{In(CH3)3} + AsH3 → InxGa1-xAs + 3 CH4.
Необходимо заметить, что степень окисления +3 является характерной степенью окисления для элементов Al, Ga, In. Элементы P и As в разных соединениях проявляют разную степень окисления, например в фосфине P-3H+13 степень окисления фосфора -3, а в фосфорном ангидриде P2O5 фосфор проявляет свою максимальную степень окисления +5.
Элемент Zn (Z=30) – это типичный металл, внешний электронный слой можно записать формулой 4s2, проявляет характерную степень окисления +2. Элемент теллур Te (Z=52) –это полупроводник, внешний электронный слой имеет вид 5s25p4, т.е. элемент способен проявлять степень окисления +4 и +6. Элемент углерод С часто проявляет степень окисления +4 (2s22p2), хотя, как следует из вида внешнего электронного слоя в ряде соединений способен проявлять степень окисления +2 (как, например в молекуле оксида углерода СО).
Кремний Si (характерная степень окисления +4) в основном используется при эпитаксиальном росте GaAs, как n-лиганд, а углерод С, как р-лиганд.
Чтобы увеличить уровень n-легирования в общем случае необходимо повысить температуру в реакторе, а также увеличить отношение элементов V/III групп. Увеличение температуры усиливает эффект деструкции силана SiH4, что производит большее количество n-лиганда (Si) и атомарного водорода Н. Кремний будет легировать материал растущего слоя, а атомарный водород будет взаимодействовать с метильными радикалами с образованием метана CH4. Особенность СBr4 состоит в том, что в плазме реакция гидрирования бромида углерода протекает достаточно быстро по сравнению с непосредственно реакцией легирования углеродом структуры растущего слоя. Чтобы усилить действие р-лиганда без добавления его дополнительного количества, надо понизить температуру и/или отношение элементов групп V/III. Снижение отношения V/III до 0,9-1,1 повлечёт снижение количества атомарного водорода из разлагающихся гидридов, что сдвинет равновесие реакции гидрирования бромида углерода влево, т.е. позволит большему количеству атомов С быть вовлечённым в растущую структуру, как р-лиганд.
В PECVD реакторах используются следующие вешества:
1) Кремнийсодержащий газ – силан SiH4 (М.М.=32, структура молекулы дана ниже, слева). Температура плавления -186оС, температура кипения -111оС, это бесцветный газ, плотность при 15оС ~1,35 г/л, в баллоне находится в газообразном состоянии (критическая температура Tkр = -3,6оС). На рисунке ниже представлены кривые давления силана (100%) в 50-ти литровом баллоне при 10 и 20оС.

Особенность конкретной технологии получения a-Si:H в том, что дополнительно используются дисилан Si2H6 и моногерман GeH4. Дело в том, что при росте первой p-i-n структуры (ближайщей к подложке) при росте слоя с собственной проводимостью (i) используется газовая смесь Si2H6/GeH4. Цель – получить слой гидрогенизированного аморфного сплава состава a-Si:Ge:H, обладающего чувствительностью к красной части солнечного спектра.
2) Кремнийсодержащий газ – дисилан Si2H6 (М.М.=62,22). Температура
плавления -131оС, температура кипения -14,5оС, это бесцветный газ, плотность при -25оС ~0,686 г/л. В баллоне находится в сжиженном состоянии (критическая температура 151оС).
3) Герман – GeH4 (М.М.=76,63), точка кипения -88,4оС, при комнатной температуре – это бесцветный газ, температурная зависимость давления паров описывается формулой:
Log10P(mm Hg) = 7,015-758,3/T(K) (cм. рисунок ниже, справа). В баллоне герман (100%) находится в сжиженном состоянии (критическая температура = 38,5оС).
Замечание: Официально зарегистрированы два случая самопроизвольного взрыва (или спонтанного разложения) сжиженного германа в баллоне. В связи с этим в Европе и Америке запрещено использовать сжиженный герман, герман используют только в виде газовой смеси с содержанием основного газа не более 20% об. В частности, в машине PECVD для осаждения слоя аморфного кремния/германия используется газовая смесь 20% германа в водороде.
В качестве легирующих веществ используются гидриды V и III групп, а именно фосфин РН3 (Р используется как n-лиганд со степенью окисления +5) и трифторид бора BF3(В используется как р-лиганд со степенью окисления +3). Вместо BF3 иногда используют газ диборан B2H6.
Соударения электронов с молекулами силана являются основным событием в плазме. Свободные электроны, имеющие различные энергии в плазме, при столкновении перебрасывают электроны с основной молекулярной орбиты силана в некоторые возбуждённые состояния, зависящие от энергии свободных электронов. Возбуждённые электронные состояния молекул силана являются диссоциативными, это означает спонтанную диссоциацию молекул с этих возбуждённых состояний до различных радикалов таких, как SiH3, SiH2, SiH, Si, H и других частиц (см. рис. ниже).

Излучающие частицы SiH* и Si*, как видно из рис., также возникают в результате одноэлектронного соударения с молекулами силана, когда энергия свободных электронов больше, чем 10,33 и 10,53 эВ соответственно. Ионные частицы получаются в результате одноэлектронных столкновений с более энергоёмкими электронами. Нейтральные радикалы, полученные в результате диссоциации молекул силана, вызывают вторичные реакции главным образом с молекулами силана же, формируя стабильное состояние в плазме. Таблица (представленная ниже) показывает численную плотность радикалов, излучающих частиц и ионов в стабильной силановой плазме, измеренную различными способами. Стабильная плотность радикалов возникает благодаря балансу между их скоростями генерации и аннигиляции в плазме.
Таблица. Стабильная численная плотность радикалов, излучающих частиц и ионов в реальной силановой плазме
________________________________________________________________________________________
Радикалы и ионы Метод определения Плотность в плазме/см3
_____________________________________________________________________________________________________________________________________________________________
SiHx+, Hx+ Mass spectrometry 108 –109
Si*, SiH* Luminosity 105
Si Laser-induced fluorescence 108 –109
SiH Laser-induced fluorescence 108 –109
SiH2 Intra-cavity laser absorption 109
SiH3 Infrared laser absorption 1012
Как видно из представленной таблицы, радикалы SiH3 имеют самую высокую плотность (1012/см3) в плазме благодаря отсутствию реакционной способности этих частиц с SiH4, в то время как SiH2, SiH и Si (их называют короткоживущими радикалами) показывают на 3 порядка величины меньшую плотность по сравнению с SiH3 из-за их сильной реакционной способности с SiH4 (см. реакции ниже):
SiH2 + SiH4 → Si2H6 → SiH3 + SiH3,
SiH + SiH4 → SiH2 + SiH3,
Si + SiH4 → SiH + SiH3.
Поэтому радикалы SiH3 считаются главными предшественниками плёнки аморфного гидрогенизированного кремния а-Si:H, т.е. теми «кирпичиками», из которых строится эта плёнка.
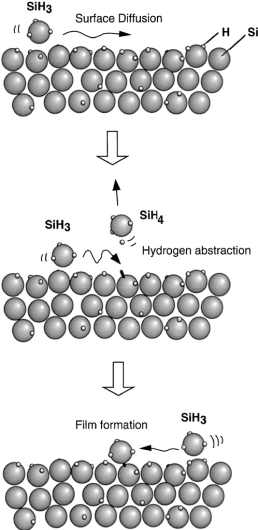
Модель поверхностной реакции с участием SiH3 предложена, как показано на рис. ниже, на основании нескольких очевидных фактов. SiH3, достигая растущей поверхности, которая почти полностью покрыта связанным водородом при температуре <350 оС, начинает диффундировать по поверхности. Далее радикал SiH3 извлекает поверхностный водород с образованием молекулы SiH4 и оставляя свободную связь на поверхности. Другая диффундирующая частица SiH3 находит эту связь и формирует связь Si-Si. Такова упрощенная модель, объясняющая рост плёнки а-Si:H из силановой плазмы.
|
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 671; Нарушение авторских прав?; Мы поможем в написании вашей работы!