
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электродвижущая сила (Э.Д.С.) гальванического элемента
|
|
|
|
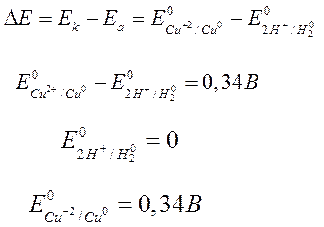
| Уравнение Нернстапозволяет рассчитать
потенциалы электродов при условиях, отличающихся от стандартных
Е -потенциал электрода в условиях, отлич. от стандартных, В; Е0 -стандартный электродный потенциал, В; R -универсальная газовая постоянная, F -число Фарадея, n -число электронов, принимающих участие в окислительно-восстановительном процессе; a окисл. ф. - активность окисленной формы, моль/л; a восст. ф. - активность восстановительной формы, моль/л;
| |||
Для разбавленных растворов
 [ C окис.ф ] и [ C восст.ф. ] - концентрации, окисленной и восстановленной форм, моль/л.
[ C окис.ф ] и [ C восст.ф. ] - концентрации, окисленной и восстановленной форм, моль/л.
| ||||
Ур-ие Нернста для металлич. электрода:
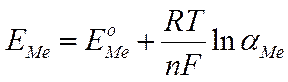
| Формула Нернста справедлива для расчетов электродных потенциалов, характеризующих только обратимые процессы, находящиеся в состоянии равновесия. |
Обратимый процесс позволяет достичь состояния равновесия, характеризующегося балансом как по зарядам, так и по веществу. Если потеря электронов на электроде осуществляется каким-либо одним веществом, а присоединение - другим, то процесс будет необратимым.
Виды обратимых электродов: металлические электроды I рода, металлические электроды II рода, окислительно - восстановительные электроды, газовые электроды.
Металлические электроды I рода представляют собой металл, погруженный в раствор соли этого металла. медный электрод Cu / CuSO4;цинковый электрод Zn/ZnSO4. Потенциалы таких электродов зависят от активности ионов металла в растворе.
Металлические электроды II рода редставляют из себя металлические электроды, покрытые труднорастворимым соединением данного металла, например, солью, оксидом или гидроксидом, и погруженные в раствор хорошо растворимого соединения, имеющего общий с труднорастворимым соединением анион.(хлорсеребряный электрод - Ag/AgCl/KCl каломельный электрод - Hg/Hg2Cl2/KCl.) Потенциалы металлических электродов II рода будут определяться активностью (концентрацией) общего с труднорастворимым соединением аниона в растворе.
|
|
|
Окислительно – восстановительные электроды (редокс - электроды) образуются при погружении графита или иного инертного металла (платина, золото, иридий и др.) в окислительно - восстановительную среду. Возникающий при этом окислительно - восстановительный потенциал (редокс - потенциал) обусловлен равновесием: окисленная форма Û восстановленная форма
Газовые электроды представляют собой металлический проводник, контактирующий одновременно и с газом и с раствором, содержащим ионы данного газа. Напр.: водородный, хлорный, кислородный электроды.
.::Поляризация
Виды поляризации:
В зависимости от причин, вызывающих поляризацию, различают два ее вида:
¡ Концентрационная поляризация;
¡ Электрохимическая поляризация.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 439; Нарушение авторских прав?; Мы поможем в написании вашей работы!
