
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
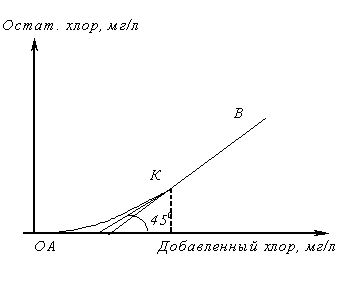
Хлоремкость
Прежде чем решить вопрос об очистке сточной воды хлорированием, ее специально исследуют. При этом необходимо определить, с какой скоростью проходят реакции между содержащимися в воде веществами и хлором, доходят ли они до конца, какой требуется избыток добавляемого хлора для того, чтобы реакция прошла в желаемой степени в заданный промежуток времени t.
ОА – показывает содержание веществ, быстро окисляющихся хлором.
АК – процесс окисления и хлорирования веществ, медленно реагирующих с хлором, которые за время опыта не успевают прореагировать и остаются в растворе вместе с остаточным хлором.
КВ – отсутствие веществ, реагирующих с хлором.
Активный хлор
Хлор, присутствующий в воде в виде хлорноватистой кислоты (HClO) или гипохлорит-аиона (ClO-), принято называть свободным хлором. Хлор, существующий в виде хлораминов (монохлорамин - NH2Cl и дихлорамин – NHCl2, а также в виде треххлористого азота NCl3, называют связанным хлором Свободный хлор достаточно часто применяют для дезинфекции питьевой и сточной воды. В промышленности хлор используют при отбеливании в бумажном производстве, производстве ваты, для уничтожения паразитов в холодильных установках и т.д. При растворении хлора в воде образуются соляная и хлорноватистая кислоты:
Cl2 + H2O = H+ + Cl- + HClO.
В природной воде содержание активного хлора не допускается; в питьевой воде его содержание установлено в пересчете на хлор на уровне 0,3-0,5 мг/л в свободном виде и на уровне 0,8-1,2 мг/л в связанном виде. Активный хлор в указанных концентрациях присутствует в питьевой воде непродолжительное время (не более нескольких десятков минут) и нацело удаляется даже при кратковременном кипячении воды. Анализ отобранной пробы на содержание активного хлора следует проводить немедленно.
Определение активного хлора основано на свойстве всех содержащих активный хлор соединений в кислой среде выделять из иодида калия свободный иод:
Cl2 + 2I- = I2 + 2Cl-ClO- + 2H+ + 2I- = I2 + 2Cl- + H2O
HClO + H+ + 2I- = I2 + Cl- + H2O
NH2Cl+ 2H+ + 2I- = I2 + NH4+ +Cl-.
Свободный иод оттитровывают тиосульфатом натрия в присутствии крахмала. Реакцию проводят в буферном растворе при рН 4,5.
Чувствительность метода – 0,3 мг/л при объеме пробы 250 мл, однако, при использовании растворов тиосульфата с различной концентрацией объем пробы может составлять, в зависимости от требуемой чувствительности определения, от 500 до 50 мл воды и менее. Лимитирующий показатель вредности для активного хлора – общесанитарный.
Окисляемость или химическое потребление кислорода (ХПК)
Величина, характеризующая содержание в воде органических и минеральных веществ, окисляемых одним из сильных химических окислителей при определенных условиях, называется окисляемостью.
Существует несколько видов окисляемости воды: перманганатная, бихроматная, иодатная, цериевая. Наиболее высокая степень окисления достигается методами бихроматной и иодатной окисляемости воды. Окисляемость выражается в миллиграммах кислорода, пошедшего на окисление органических веществ, содержащихся в 1 л воды.
Состав органических веществ в природных водах формируется под влиянием многих факторов. К числу важнейших относятся внутриводоемные биохимические процессы продуцирования и трансформации, поступления из других водных объектов, с поверхностными и подземными стоками, с атмосферными осадками, с промышленными и хозяйственно-бытовыми сточными водами. Образующиеся в водоеме и поступающие в него извне органические вещества весьма разнообразны по своей природе и химическим свойствам, в том числе по устойчивости к действию разных окислителей. Соотношение содержащихся в воде легко- и трудноокисляемых веществ в значительной мере влияет на окисляемость воды в условиях того или иного метода ее определения.
В поверхностных водах органические вещества находятся в растворенном, взвешенном и коллоидном состояниях. Последние в рутинном анализе отдельно не учитываются, поэтому различают окисляемость фильтрованных (растворенное органическое вещество) и нефильтрованных (общее содержание органических веществ) проб.
Величины окисляемости природных вод изменяются в пределах от долей миллиграммов до десятков миллиграммов в литре в зависимости от общей биологической продуктивности водоемов, степени загрязненности органическими веществами и соединениями биогенных элементов, а также от влияния органических веществ естественного происхождения, поступающих из болот, торфяников и т.п.
Поверхностные воды имеют более высокую окисляемость по сравнению с подземными (десятые и сотые доли миллиграмма на 1 л), исключение составляют воды нефтяных месторождений и грунтовые воды, питающиеся за счет болот. Горные реки и озера характеризуются окисляемостью 2–3 мг л, реки равнинные – 5–12 мг О/л, реки с болотным питанием – десятки миллиграммов на 1 л. Окисляемость незагрязненных поверхностных вод проявляет довольно отчетливую физико-географическую зональность.
| Таблица № 8. Физико-географическая зональность природных вод | ||
| Окисляемость | мг О/л | Зона |
| Очень малая | 0–2 | Высокогорье |
| Малая | 2–5 | Горные районы |
| Средняя | 5–10 | Зоны широколиственных лесов, степи, полупустыни и пустыни, а также тундра |
| Повышенная | 15–20 | Северная и южная тайга |
Окисляемость подвержена закономерным сезонным колебаниям. Их характер определяется, с одной стороны, гидрологическим режимом и зависящим от него поступлением органических веществ с водосбора, с другой, – гидробиологическим режимом.
В водоемах и водотоках, подверженных сильному воздействию хозяйственной деятельности человека, изменение окисляемости выступает как характеристика, отражающая режим поступления сточных вод. Для природных малозагрязненных вод рекомендовано определять перманганатную окисляемость; в более загрязненных водах определяют, как правило, бихроматную окисляемость (ХПК).
В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого водопользования величина ХПК не должна превышать 15 мг О/л; в зонах рекреации в водных объектах допускается величина ХПК до 30 мг О/л.
В программах мониторинга ХПК используется в качестве меры содержания органического вещества в пробе, которое подвержено окислению сильным химическим окислителем. ХПК применяют для характеристики состояния водотоков и водоемов, поступления бытовых и промышленных сточных вод (в том числе, и степени их очистки), а также поверхностного стока. ХПК – величина, характеризующая общее содержание в воде восстановителей (органических и неорганических), реагирующих с сильными окислителями. Величину ХПК выражают в единицах количества кислорода, расходуемого на окисление.
Зная величину ХПК можно достаточно точно определить содержание органических веществ в воде, использую следующий алгоритм:
определить химическими методами содержание в воде неорганических восстановителей; рассчитать количество кислорода, необходимое для их окисления; вычесть их ХПК рассчитанное количество кислорода; по разнице рассчитать содержание органических веществ-восстановителей.
| Таблица № 9. Величины ХПК в водоемах с различной степенью загрязненности | |
| Степень загрязнения (классы водоемов) | ХПК, мг О/л |
| Очень чистые | |
| Чистые | |
| Умеренно загрязненные | |
| Загрязненные | |
| Грязные | 5–15 |
| Очень грязные | >15 |
Для вычисления концентрации углерода, содержащегося в органических веществах, значение ХПК (мг О/л) умножается на 0,375 (коэффициент, равный отношению количества вещества эквивалента углерода к количеству вещества эквивалента кислорода).
Бихроматная окисляемость позволяет получить значение ХПК, наиболее приближенную к ХПКтеор., т. е. наиболее полное окисление достигается бихроматом калия (основной метод). В условиях этого метода большинство органических соединений окисляется на 95 % и более, однако окисляются не все соединения (толуол, бензол, пиридин, парафин практически не окисляются).
Катализатор – сульфат серебра. Избыток бихромата оттитровывается раствором соли Мора. Реакцию проводят в жестких условиях – в 50 % - ной (18 н) H2SO4 при кипячении.
Cr2O72- + 14H+ + 6e- = 2Cr3+ + 7H2O
ПДК = 95 – 98 % от ХПК теор.
В качестве индикатора используют ферроин – комплекс 1,10 – фенантролина с сульфатом железа(II). При этом катион Fe2+ реагирует с катионом хрома:
3Fe2+ + Cr6+ = 3Fe3+ + Cr3+.
Индикатор образует интенсивно окрашенное соединение с Fe2+ бесцветное – с Fe3+. В точке эквивалентности окраска раствора меняется с синевато – зеленой до красно – коричневой.
ХПК в Международной терминологии называется COD «Chemical oxygen demand». При этом имеется в виду исключительно бихроматная окисляемость.
Перманганатная окисляемость (за рубежом – «перманганатный индекс»).
MnO4- + 8H+ + 3e- = Mn4+ + 4H2O
Определение перманганатной окисляемости может быть рекомендовано лишь при анализе природных вод для контроля за динамикой содержания легкоокисляющихся веществ природного происхождения. Согласно СанПиН 2.1.559 – 96 регламентируется ХПК именно по перманганатной окисляемости.
Для питьевой воды норматив составляет 5,0 мг О/л
|
|
Дата добавления: 2014-01-11; Просмотров: 456; Нарушение авторских прав?; Мы поможем в написании вашей работы!