
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фотохимические реакции
|
|
|
|
Известно, что для осуществления химической реакции необходима энергия большая или равная энергии активации. Активные частицы находятся в термическом равновесии с остальными молекулами.
Существует класс реакций с нетермической активацией реагирующих веществ. В них энергия, необходимая для активации молекул поступает извне, например, при поглощении кванта электромагнитного излучения, при воздействии плазмы или электрического разряда. Если реакции происходят при поглощении квантов электромагнитного излучения, то их называют фотохимическими.
Если реакции происходят в плазме электрического разряда, то это плазмохимические реакции.
Если реакции протекают при воздействии быстрых элементарных частиц или g- излучения – то они радиационно-химические.
Некоторые общие черты реакций с нетермической активацией:
1. Первая стадия этих реакций связана с возникновением активных частиц и увеличение их доли под воздействием внешних факторов. Вторая стадия – взаимодействие активных частиц с другими частицами.
2. При нетермической активации возникает гораздо больше активных частиц, чем при их термическом образовании. В результате концентрации получающихся продуктов гораздо больше, равновесных концентраций для термически-активируемых реакций. То есть обеспечивается сверхравновесный выход продуктов. Поэтому термодинамический подход для этих реакций не всегда оправдан.
3. Скорость первой стадии нетермически активируемых реакций мало зависит от температуры, и температура вообще незначительно меняет скорость реакций в целом.
Рассмотрим более подробно некоторые особенности таких реакций на примере фотохимических реакций (ФХР), то есть реакций, которые происходят под действием света. Эти реакции протекают под влиянием инфракрасного, ультрафиолетового и видимого светового излучения в газообразных, жидких и твердых средах (длина волны l=200-700 нм).
|
|
|
Энергия одного кванта света связана с длиной волны соотношением
 (1)
(1)
где h — постоянная Планка, 6,626 · 1034 дж·с; с — скорость света, 3·108 м·c-1;
ν — частота излучения(с-1); λ— длина волны излучения (м).
Один моль квантов света иногда называют эйнштейном.
 (2)
(2)
где NA — число Авогадро, 6,02 · 1023 молекул/моль;
 -это 1 эйнштейну (1 Эс), или энергия одного моля фотонов при данной длине волны.
-это 1 эйнштейну (1 Эс), или энергия одного моля фотонов при данной длине волны.
Количество световой энергии, падающей на единицу площади системы в единицу времени, называется интенсивностью света (Io). Интенсивность светового потока после его прохождения через слой вещества толщиной l обозначается It. Отношение интенсивности светового потока после прохождения через слой вещества к начальной интенсивности светового потока (It /Io) называется пропусканием, а отрицательный логарифм пропускания называется оптической плотностью (- lg (It /Io)).
Объединенный закон Буге—Ламберта—Бера (БЛБ):
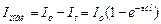 (3)
(3)
где l - толщина слоя вещества; с - концентрация поглощающего свет вещества;  - мольный коэффициент поглощения. Величина его выражена в л/(моль×см), зависит от длины волны и для сильнопоглощающих веществ может достигать 105 л/(моль×см). Обычный диапазон величин –десятки и сотни.
- мольный коэффициент поглощения. Величина его выражена в л/(моль×см), зависит от длины волны и для сильнопоглощающих веществ может достигать 105 л/(моль×см). Обычный диапазон величин –десятки и сотни.
Этот объединенный закон применим только к системам, в которых растворенное вещество не диссоциирует, не ассоциирует, не взаимодействует с растворителем.
Любая фотохимическая реакция является сложным многостадийным процессом. Первичный процесс состоит из стадии поглощения кванта энергии и сразу следующей за ней стадии превращения возбужденной молекулы. Начальная стадия поглощения света  приводит к образованию электронно-возбужденной молекулы, при этом энергия электромагнитных колебаний трансформируется в энергию движения электронов, которые переходят на более высокий энергетический уровень. Эта стадия с химической точки зрения протекает мгновенно и заканчивается за время τ = 10-15 -10-17 с.
приводит к образованию электронно-возбужденной молекулы, при этом энергия электромагнитных колебаний трансформируется в энергию движения электронов, которые переходят на более высокий энергетический уровень. Эта стадия с химической точки зрения протекает мгновенно и заканчивается за время τ = 10-15 -10-17 с.
|
|
|
На следующей стадии возбужденная молекула претерпевает превращение по одному из возможных направлений:
| Химические первичные процессы | |
1.  A + B A + B
| диссоциация на свободные атомы или радикалы |
2.  A B A B
| Изомеризация |
3. 
| химическая реакция (с участием другого вещества или внутримолекулярно) |
| Фотофизические первичные процессы | |
4.  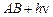
| излучательные процессы (флуоресценция или фосфоресценция) |
5.  AB + тепло AB + тепло
| безызлучательные процессы - внутренняя конверсия |
6. 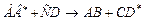
| дезактивация при соударении или на стенке |
Флуоресценция-это быстрое испускание света и переход в исходное электронное состояние. Частота испускаемого света меньше или равна частоте поглощаемого в начальной стадии света. Фосфоресценция-испускание света с некоторой задержкой во времени которая необходима для того, чтобы молекула за счет безызлучательных процессов перешла в другое возбужденное состояние.
Вторичные процессы протекают без участия света (их называют также «темновыми» реакциями). К ним относятся
•Реакции свободных радикалов (появившихся в первичных процессах) с молекулами реагента
•Реакции дезактивации образовавшихся в первичном акте молекул
•Реакции рекомбинации свободных атомов и радикалов.
Вторичные ФХР в сущности фотохимическими не являются, поскольку не требуют фотохимической активации и протекают как обычные реакции с чисто термическим характером активации. В то же время продукты, получаемые по ФХР и во вторичных процессах часто бывают тождественны и экспериментально неразличимы. Например при реакции водорода и хлора на каждый «фотохимический» атом хлора при поглощении одного фотона, образуется 105 «темновых» атомов, поэтому при освещении реакция идет со взрывом и тут квантовый выход гораздо больше единицы.
В основе кинетики фотохимических реакция лежат следующие Законы фотохимии
1. Закон Гротгуса (1817 г.) — Дрепера (1844 г.): только поглощенный средой свет может произвести ее химическое изменение или химически активны лишь те лучи, которые поглощаются данной реакционной смесью.
|
|
|
2. Закон фотохимической эквивалентности Эйнштейна – Штарка (1912 г.): каждый поглощённый в первичном акте квант света вызывает превращение одной молекулы.
3. Закон Вант-Гоффа (1904 г.): скорость ФХР пропорциональная интенсивности поглощенного исходным веществом светового потока.
Объединение закона Буге-Ламберта-Бера с законом Вант-Гоффа приводит основному кинетическому уравнению для фотохимических реакций.
Скорость первичной ФХР – это число молей вещества, которое активизируется в результате поглощения световой энергии в единицу времени в единице объема.
По закону Вант-Гоффа скорость ФХР равна
 ,(4) k - коэффициент пропорциональности.
,(4) k - коэффициент пропорциональности.
Привлекая сюда (3), получим  (5).
(5).
Проанализируем (5).
Если  , то
, то  и из (5) имеем
и из (5) имеем
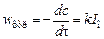 (6) т.е. скорость ФХР пропорциональна световому потоку и не зависит от концентрации реагента, т.е. имеем нулевой порядок реакции по исходному веществу.
(6) т.е. скорость ФХР пропорциональна световому потоку и не зависит от концентрации реагента, т.е. имеем нулевой порядок реакции по исходному веществу.
Если толщина поглощающего слоя очень мала или вещество неокрашено, или имеет очень малую концентрацию, т.е. в условиях слабого поглощения света,  . При этом условии экспоненту можно разложить в ряд:
. При этом условии экспоненту можно разложить в ряд:
 Ограничившись двумя первыми членами этого ряда, запишем
Ограничившись двумя первыми членами этого ряда, запишем
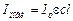 (7). Тогда уравнение (5) имеет вид
(7). Тогда уравнение (5) имеет вид  (8), т.е. скорость зависит от концентрации реагента по первому порядку реакции.
(8), т.е. скорость зависит от концентрации реагента по первому порядку реакции. 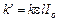 (9)
(9)
Из анализа (9): константа скорости фотохимической реакции зависит от интенсивности падающего излучения, коэффициента поглощения. Позже будет показано, что она еще зависит от квантового выхода.
Кинетика фотохимических реакция описывается обычными дифференциальными уравнениями, выражающими закон действующих масс.
Число молей вещества 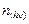 , которое в единицу времени в единице объема переходит в возбужденное состояние под действием излучения и может участвовать в первичной ФХР (по сути это скорость первичной фотохимической реакции
, которое в единицу времени в единице объема переходит в возбужденное состояние под действием излучения и может участвовать в первичной ФХР (по сути это скорость первичной фотохимической реакции 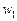 ) можно найти как
) можно найти как
 (9)
(9)
Или с учетом (3) 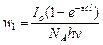 (10)
(10)
Если бы каждая молекула, поглотившая квант света, претерпевала химическое превращение, то скорость фотохимической реакции определялась бы по формуле (10), но между тем при опытной проверке законов фотохимии выяснилось, что количество прореагировавших молекул меньше количества активированных. В связи с этим была введена поправка, называемая квантовым выходом.
|
|
|
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1934; Нарушение авторских прав?; Мы поможем в написании вашей работы!