
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Електрогравіметрія
|
|
|
|
Електрохімічний аналіз, який полягає у визначенні кількості катіонів металу у розчині, які виділяють на попередньо зваженому електроді у вигляді:
- вільного металу на катоді, наслідок електровідновлення: Cu2++2e=Cu;
- у вигляді оксиду металу на аноді в наслідок електроокиснення: Mn2+-2e+O2=MnO2.
За збільшенням маси електрода в процесі електролізу визначають вміст Меn+ в досліджуваному розчині.
Електроліз описується законом Фарадея, який формується так: маса речовини, яка виділяється на електроді прямо пропорційна силі струму, часу його проходження, молярній масі і обернено пропорційна кількості електронів, які приймають участь у електрохімічному процесі, і числу Фарадея:
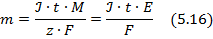
Цим методом можна визначити не лише окремі метали, але і кілька металів з розчину їх суміші окремо за умови, що мінімальна різниця потенціалів їх розрядження ∆Е ≥ 0,4В для двозарядних катіонів і ∆Е ≥ 0,2В для однозарядних.
Приклад 1. У розчині присутні Ag+ , Cu2+ , Cd2+, стандартні редокс-потенціали яких становлять: Е0Ag+/Ag = 0,8В; Е0Cu2+/Cu = 0,34В; Е0Cd2+/Cd = -0,4В. Їх можна розділити і визначити кожен окремо у вигляді металів, оскільки різниці їх стандартних потенціалів значно відрізняються(∆Е0>0,2В)
Приклад 2. Якщо ця умова не виконується, то потенціали розрядження можна змінити, зв’язуючи один із катіонів металу у комплекс. Cu і Ві з розчину їх сульфатів одночасно виділити неможливо оскільки їх стандартні потенціали близькі за величиною: Е0Ві3+/Ві=0,32В; Е0Cu2+/Cu=0,34В. При додаванні KCN Сu2+ переходить у комплекс K2[Cu(CN)4] і потенціал розрядження Сu2+ знижується до -1В. За цих умов можна окремо виділити кожен із металів.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 489; Нарушение авторских прав?; Мы поможем в написании вашей работы!