
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кулонометрія
|
|
|
|
Цей метод електрохімічного аналізу, який ґрунтується на вимірюванні кількості електричного струму, витраченого на електрохімічне перетворення аналізованої речовини, ґрунтується на законах електролізу.
Кулонометрію використовують тоді, коли електрогравіметричний метод застосувати не можна:
- коли на електроді виділяється невелика кількість речовини, що зменшує точність аналізу;
- продукт реакції є рідина або газоподібна сполука.
В кулонометричному аналізі використовують 2 електролітичні комірки: у першій знаходиться досліджуваний розчин у другій, яка називається кулонметром, відбувається електрохімічна реакція з виходом за струмом 100%.
 |



 1-комірка з аналізованим розчином;
1-комірка з аналізованим розчином;

 2-потенціостат;
2-потенціостат;

 3-вольтметр;
3-вольтметр;
 4-амперметр;
4-амперметр;

 5-кулонометр.
5-кулонометр.



Рис. 5.2 Схема приладу для проведення кулонометричного аналізу
Оскільки кількість електричного струму, що проходить через досліджуваний розчин і кулонометр, однакова, то відношення:
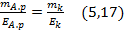
де mа.р.і mк – маса речовини, що виділяється в процесі електролізу аналізованого розчину і того, який знаходиться у кулонометрі, відповідно;
Еа.р і Ек – їх молярні маси еквівалентів.
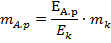
Типи кулонометрів:
I. Гравіметричний кулонометр (мідний або срібний)
Ag+ + е = Ag; Cu2++2e= Ag
Кількість струму, який пройшов через кулонометр, а отже, і через досліджуваний розчин, розраховують за збільшенням маси електрода кулонметра.
|
|
|
II. Титраційний кулонометр. Кількість струму визначають за об’ємом розчину тіосульфату натрію, витраченого на титрування йоду, що утворився в результаті електролізу йодиду калію:
2I- - 2e = I2
I2 + 2S2O32- → 2I- + S4O62-
III. Газовий кулонометр. Фіксують сумарний об’єм водню і кисню, виділених у процесі електролізу води, і розраховують кількість пройденого електричного струму через кулонометр і електролітичну комірку з досліджуваним розчином.
(-) H2O + 2e → H2 ↑ + 2OH-
(+) 2H2O - 4e = O2↑ +4H+
Пряму кулонометрію використовують, як високоточний і високоселективний метод, який дає змогу визначати вміст речовини до 10-5 моль/л.
Цим методом визначають:
- іони металу;
- нітро- і галоген похідні при катодному відновленні;
- Hal – іони;
- іони металів у нижчих ступенях окиснення при анодному окисненні.
Кулонометричне «титрування»
Використовується значно частіше, ніж пряма кулонометрія, оскільки цим методом можна визначити як електроактивні, так і електронеактивні сполуки, здатні кількісно реагувати з титрантом у кислотно основних, окисновідновних реакціях, реакціях осадження.
Титрант не вводять зовні, він утворюється на генераторному електроді внаслідок електрохімічної реакції (електрогенерації титранта) за участю:
а) розчинника в наслідок відновлення води до OH-
2 H2O + 2e = H2+ 2OH - (титрант)
СН3СООН + ОН-→СН3СОО- + Н2О;
б) Матеріал аноду (окиснення срібла до Ag+)
Ag – e → Ag+ (титрант)
Cl-+Ag+→AgCl
в) Допоміжного реагенту (окиснення йодид-іонів до вільного йодиду);
2I- - 2e = I2 (титрант)
AsO33-+I2+H2O= AsO43-+2I-+2H+
Кулонометричне титрування має ряд переваг, порівняно з прямою кулонометрією, оскільки розширює спектр визначення речовин, відсутня необхідності приготування розчинів титр антів, їх стандартизація і зберігання.
За допомогою одного і того ж джерела струму можна готувати різні титранти, зокрема і не стійкі за звичайних умов. У кулонометричному титруванні можна визначати малі кількості речовини (10-4, 10-5 моль/л)
|
|
|
Індикацію кінця титрування проводять за допомогою індикаторів, чи одним із інструментальних методів фотоколориметричним, потенціометричним, амперметричним, при цьому фіксують зміну оптичної густини розчину, величини потенціалу індикаторного електрода, сили струму.
|

|
|


 | |||
 | |||
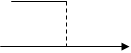
т.е τ т.е τ
Fe2+ + Ce2+→ Fe3+ + Ce3+ (титрування) [Fe(CN)6]3- + e = [Fe(CN)6]4- (генерація «титранта»)
Ce4+: Ce3+ - e → Ce2+ (генерація «титранта») Zn2+ + 2K++[Fe(CN)6]3-→ K2Zn3[Fe(CN)6]2↓(титрування)
Рис. 5.3. Криві кулонометричного титрування.
Кулонометричне титрування проводять:
- за постійної сили струму (у гальваностатичному режимі)
- за постійної напруги (у потенціостатичному режимі)
В кулонометричному титруванні використовують всі типи реакцій титрометричного аналізу:
- кислотно-основні взаємодії (визначають малі кількості кислот і основ (10-4-10-5 моль/л) з електрогенерованими гідроксид-іонами та протонами;
- осадження (визначають галогенід- та сульфід іони з електрогенеративними йонами Ag+);
- комплексоутворення (зокрема, комплексонометрію) (катіони металів «титрують» розчином електрогенерованого із Hg2- трилоном Б – HgY2- + 2e= HgY2+ Hg);
- окиснення-відновлення (електрогенерованим «титрантом» - бром - «титрують»відновники (І-, AsO33-, гідразин) та фелол, який при цьому хромується).
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1912; Нарушение авторских прав?; Мы поможем в написании вашей работы!