
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ядерная модель атома. Опыты Резерфорда. Теория Бора
Лекция 8. Элементы атомной физики
В 1905 г. Дж. Томсоном была предложена первая модель атома. Согласно этой модели атом представляет собой шар с равномерно распределенным положительным зарядом, внутри которого около своих положений равновесия колеблются электроны.
В 1911 г. Резерфорд, бомбардируя a -частицами ( м / с) металлическую фольгу, определял углы их рассеяния на атомах мишени, регистрируя сцинтилляции на экране, покрытом сернистым цинком. Основная часть a -частиц испытывала незначительные отклонения, но некоторые резко изменяли направление своего движения. Так как электроны не могут значительно повлиять на движение столь тяжелых и быстрых частиц, Резерфорд пришел к выводу о существовании ядра, в котором сосредоточен весь положительный заряд и почти вся масса атома. На основании своих исследований он предложил ядерную (планетарную) модель атома. Согласно этой модели вокруг положительно заряженного ядра (с зарядом Ze) по замкнутым орбитам движутся электроны. Так как атомы нейтральны, то заряд ядра равен суммарному заряду электронов.
м / с) металлическую фольгу, определял углы их рассеяния на атомах мишени, регистрируя сцинтилляции на экране, покрытом сернистым цинком. Основная часть a -частиц испытывала незначительные отклонения, но некоторые резко изменяли направление своего движения. Так как электроны не могут значительно повлиять на движение столь тяжелых и быстрых частиц, Резерфорд пришел к выводу о существовании ядра, в котором сосредоточен весь положительный заряд и почти вся масса атома. На основании своих исследований он предложил ядерную (планетарную) модель атома. Согласно этой модели вокруг положительно заряженного ядра (с зарядом Ze) по замкнутым орбитам движутся электроны. Так как атомы нейтральны, то заряд ядра равен суммарному заряду электронов.
При движении электрона вокруг ядра по круговой орбите радиуса r кулоновская сила взаимодействия сообщает ему центростремительное ускорение. Тогда второй закон Ньютона примет вид
 =
=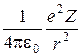 .
.
 Согласно классической электродинамике, ускоренно движущиеся электроны должны излучать электромагнитные волны и вследствие этого непрерывно терять энергию. В результате электроны будут приближаться к ядру и в конце концов упадут на него.
Согласно классической электродинамике, ускоренно движущиеся электроны должны излучать электромагнитные волны и вследствие этого непрерывно терять энергию. В результате электроны будут приближаться к ядру и в конце концов упадут на него.
Излучение невзаимодействующих друг с другом атомов состоит из отдельных спектральных линий. В соответствии с этим спектр испускания атомов называется линейчатым.
Швейцарский физик Бальмер (1885) подобрал эмпирическую формулу, описывающую все известные в то время спектральные линии атома водорода в видимой области спектра:
 (
(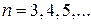 ), (8.1)
), (8.1)
где  - постоянная Ридберга.
- постоянная Ридберга.
Из этих выражений следует, что спектральные линии, отличающиеся n, образуют группу или серию линий. Формула (8.1) называется формулой Бальмера, а соответствующая серия спектральных линий водородного атома – серией Бальмера. Дальнейшие исследования показали, что в спектре водорода имеется еще несколько серий. В ультрафиолетовой области находится
серия Лаймана  (
(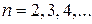 ).
).
В инфракрасной области были также обнаружены:
серия Пашена  (
(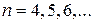 ),
),
серия Брэкета  (
(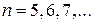 ),
),
серия Пфунда  (
( ),
),
серия Хэмфри 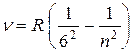 (
( ).
).
Все приведенные выше серии в спектре атома водорода могут быть описаны одной обобщенной формулой Бальмера:
 , (8.2)
, (8.2)
где m имеет в каждой серии постоянное значение 1, 2, 3,…, а n принимает целые значения, начиная с m + 1. Все эти формулы подобраны эмпирически и долгое время не имели теоретического обоснования.
Возникшие противоречия взялся разрешить Нильс Бор в 1913 г. Он предпринял первую попытку построить качественно новую квантовую теорию атома водорода, в основу которой положил два постулата:
1. Атом существуют в стационарных состояниях, в которых они не излучают и не поглощают энергию. Стационарным состояниям соответствуют стационарные орбиты, по которым движутся электроны. Электрон, двигаясь по стационарной орбите, должен иметь дискретные квантованные значения момента импульса, удовлетворяющие условию
 (
( ) (8.3)
) (8.3)
2. При переходе атома из одного энергетического состояния с энергий  в другое с
в другое с  излучается или поглощается квант энергии
излучается или поглощается квант энергии 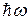 .
.
 . (8.4)
. (8.4)
Набор возможных дискретных частот квантовых переходов и определяет линейчатый спектр атома водорода.
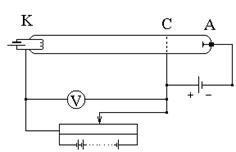 Существование дискретных уровней энергии атома было доказано немецкими физиками Франком и Герцем (1914 г.). В их опытах использовался триод, заполненный парами ртути. Между К и С создавалось ускоряющее напряжение, которое плавно менялось, а между С и А - постоянное задерживающее напряжение. Электроны, ускоренные в области 1, попадают в область 2 между сетками, где испытывают неупругие соударения с атомами паров ртути. Электроны, которые после соударений имеют достаточную энергию для преодоления задерживающего потенциала в области 3, достигают анода. Согласно боровской теории, каждый из атомов ртути может получить лишь вполне определенную энергию, переходя при этом в одно из возбужденных состояний. Поэтому если в атомах действительно существуют стационарные состояния, то электроны, сталкиваясь с атомами ртути, должны терять энергию дискретно, определенными порциями, равными разности энергий соответствующих стационарных состояний атома. Зависимость анодного тока I от ускоряющего напряжения, полученная в опыте обнаруживала максимумы, соответствующие определенным значениям U: 4,86,
Существование дискретных уровней энергии атома было доказано немецкими физиками Франком и Герцем (1914 г.). В их опытах использовался триод, заполненный парами ртути. Между К и С создавалось ускоряющее напряжение, которое плавно менялось, а между С и А - постоянное задерживающее напряжение. Электроны, ускоренные в области 1, попадают в область 2 между сетками, где испытывают неупругие соударения с атомами паров ртути. Электроны, которые после соударений имеют достаточную энергию для преодоления задерживающего потенциала в области 3, достигают анода. Согласно боровской теории, каждый из атомов ртути может получить лишь вполне определенную энергию, переходя при этом в одно из возбужденных состояний. Поэтому если в атомах действительно существуют стационарные состояния, то электроны, сталкиваясь с атомами ртути, должны терять энергию дискретно, определенными порциями, равными разности энергий соответствующих стационарных состояний атома. Зависимость анодного тока I от ускоряющего напряжения, полученная в опыте обнаруживала максимумы, соответствующие определенным значениям U: 4,86,  ,
,  В, что и свидетельствовало о дискретном изменении энергии.
В, что и свидетельствовало о дискретном изменении энергии.
|
|
Дата добавления: 2014-01-13; Просмотров: 524; Нарушение авторских прав?; Мы поможем в написании вашей работы!