
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Принцип эквивалентности
|
|
|
|
Расчеты в титриметрическом анализе
Одним из основных понятий в химии вообще и в аналитической химии в частности является понятие об эквивалентности реагирующих веществ в химической реакции. Вещества реагируют между собой в эквивалентных количествах. На этом принципе основан расчет результатов титриметрического анализа.
Если определяемое вещество А реагирует с раствором титранта В по уравнению:
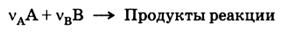
то эквивалентными массами этих веществ будут v AM(A) и v BM(B), где М(А) и М(В) – молярные массы веществ А и В, a v A и v B – стехиометрические коэффициенты или стехиометрические числа компонентов реакции.
Отсюда, уравнению можно придать вид:
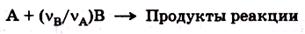
где v A > v B означает, что одна частица вещества А будет эквивалента (v A/ v B) частицы вещества В.
Отношение (v A/ v B) обозначают символом f экв(В) и называют фактором эквивалентности вещества В:
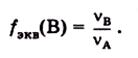
Фактор эквивалентности является безразмерной величиной, равной или меньше единицы.
Величину f экв(В)В называют эквивалентом (эквивалентной формой) В.
Однако для расчета фактора эквивалентности и эквивалента необходима фиксированная основа, т.к. одного стехиометрического уравнения реакции для проведения расчета не всегда бывает достаточно. Такой основой в реакциях кислотно-основного взаимодействия является ион водорода, а в окислительно-восстановительных – электрон.
Фактор эквивалентности – это число, обозначающее, какая доля реальной частицы вещества X эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной реакции окисления-восстановления.
Эквивалентом называют реальную или условную частицу вещества X, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной реакции окисления-восстановления – одному электрону.
|
|
|
Например, в реакции
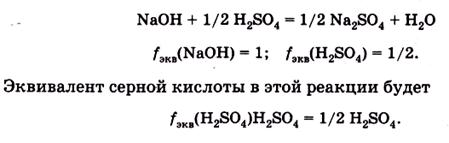
Для реакции
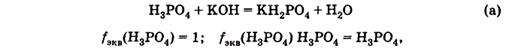

Фактор эквивалентности и эквивалент данного вещества являются не постоянными величинами, а зависят от стехиометрии реакции, в которой они принимают участие.
Важное значение в титриметрическом анализе имеет понятие о молярной массе эквивалента.
Молярной массой эквивалента вещества X называют массу одного моля эквивалента этого вещества, равную произведению фактора эквивалентности на молярную массу вещества X:
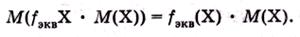
Отношение количества вещества эквивалента в растворе к объему раствора называют молярной концентрацией эквивалента:
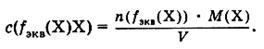
Например, с (1/2 H2S04) = 0,1 моль·экв/л.
Раствор, содержащий 1 моль эквивалентов вещества X в 1 л, называют одномолярным раствором эквивалента этого вещества.
Наряду с обозначением размерности концентрации моль·экв/л допускается сокращение «н.». Например, 1 н. H2SO4, т.е. 1 моль/л 1/2 молекулы H2SО4. При указании молярной концентрации эквивалента следует приводить конкретную реакцию, в которой данный раствор применяется, или фактор эквивалентности. Например, можно записать: с (1/2H2SO4) в кислотно-основной реакции 1 М H2S04; f экв(H2S04) = 1/2.
Наряду с молярной концентрацией эквивалента в титриметрическом анализе используют и другие способы выражения концентрации раствора: молярную концентрацию эквивалента с поправочным коэффициентом, титр, титр по определяемому веществу (условный титр).
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 4220; Нарушение авторских прав?; Мы поможем в написании вашей работы!