
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электроды первого рода. Потенциал ионно-металлического электрода
|
|
|
|
Потенциал ионно - металлического электрода. Относительная шкала электродных потенциалов. Равновесный потенциал окислительно-восстановительных систем. Мембранный потенциал и стеклянный электрод. Методы измерения pH растворов. Ион - селективные электроды.
Лекция 7. Методы расчета равновесных потенциалов. Относительная шкала электродных потенциалов
На предыдущих лекциях был рассмотрен вопрос о равновесном потенциале, т.е. таком потенциале, при котором электрод находится в равновесии с ионами того металла, из которого он состоит.
При равновесном потенциале одновременно осуществляются два условия:
1. На фазовой границе отсутствуют электрохимические или химические превращения, т.е. отсутствует ток во внешней цепи.
2. Потенциал самопроизвольно приходит к одной и той же величине как от более высоких, так и от более низких его значений.
Это динамическое равновесие, при котором скорость прямой реакции (например, растворение металла) равна скорости обратной реакции (осаждение его из раствора).
Me 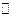 Men+ +ne (7.а)
Men+ +ne (7.а)
Такому состоянию соответствует определённая величина потенциала на границе электрод - раствор. Такой потенциал называется равновесным, поскольку он соответствует состоянию равновесия.
Рассмотрим общую реакцию ячейки, частным случаем которой является реакция (7.а):
 (7.б)
(7.б)
В.Нернстом было показано, что равновесный потенциал для реакции (7.б) может быть рассчитан из следующего уравнения:
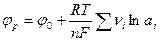 , (7.1)
, (7.1)
где R –универсальная газовая постоянная; F -константа Фарадея; n -число электронов, перенесённых в электрохимической реакции T –абсолютная температура; 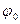 - носит название стандартного электродного потенциала.
- носит название стандартного электродного потенциала.
Из уравнения (7.1) следует, что стандартный электродный потенциал – это такой потенциал, который достигается при условии, что:
|
|
|

Величина  является постоянной величиной при постоянной температуре. Она равна 59 mB при 25°C.
является постоянной величиной при постоянной температуре. Она равна 59 mB при 25°C.
Абсолютный скачок потенциала на границе раствора определить нельзя, поэтому для измерения равновесных потенциалов используют относительные измерения, а в качестве стандартного используется водородный электрод. Его описание будет дано ниже. Стандартный потенциал водородного электрода 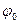 принят за “0”. Все остальные стандартные потенциалы сведены в таблицы.
принят за “0”. Все остальные стандартные потенциалы сведены в таблицы.
Классификацию электродов можно проводить по окислительно-восстановительной природе веществ, участвующих в электродном процессе.
Электродом первого рода называют систему, в которой восстановленной формой является металл электрода, а окисленной – простые или комплексные ионы этого же металла.
Рассмотрим, например, систему:
 электрод сравнения
электрод сравнения
В этой системе будет протекать реакция, которую в общем виде можно передать уравнением (7.а). Применим уравнение (7.1) к этой реакции:
 ;
; 
тогда:
 (7.2)
(7.2)
Поскольку активность металла равна 1, из (7.2) получим:
 (7.3)
(7.3)
Уравнение (7.3) позволяет рассчитать равновесный потенциал ионно – металлического электрода. В таблице (7.1) приведены значения стандартных электродных потенциалов для некоторых систем.
Таблица 7.1
Значения* стандартных электродных потенциалов для некоторых систем.
| Электродная система | 
| Электродная система | 
|
| Au / Au +3 | +1,50 | Ni / Ni + 2 | -0,250 |
| Ag / Ag + | +0,799 | Fe / Fe +2 | -0,440 |
| Cu / Cu + | +0,581 | Cr / Cr +3 | -0,74 |
| Cu / Cu +2 | +0,0337 | Zn / Zn +2 | -0,763 |
| H 2 / 2 H + | 0 | Mn / Mn +2 | -1,18 |
| Fe / Fe +3 | -0,036 | Na / Na + | -2,71 |
| Pb / Pb + 2 | -0,126 | K / K + | -2,925 |
*Значения стандартных электродных потенциалов в таблице приведены относительно водородного электрода.
Уравнение (7.3) показывает зависимость равновесного потенциала от концентрации соответствующего иона и если концентрация будет равна 1 моль/л, то  , и равновесный потенциал принимает значение стандартного равновесного потенциала
, и равновесный потенциал принимает значение стандартного равновесного потенциала 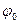 .
.
|
|
|
В таблице (7.1) приведена относительная шкала электродных потенциалов. Она представляет собой количественное выражение так называемого ряда напряжений. Все металлы, имеющие высокий положительный потенциал, носят название благородных металлов, а металлы, которые имеют более низкий потенциал, растворяются в кислотах с выделением водорода.
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 940; Нарушение авторских прав?; Мы поможем в написании вашей работы!